Az enzimek a biokémiai folyamatok nélkülözhetetlen szereplői. Képzeljük el őket apró, ám annál hatékonyabb gépezetekként, amelyek a sejtekben zajló kémiai reakciókat irányítják. Anélkülük az élet, ahogy ismerjük, egyszerűen nem létezhetne. Az enzimek katalizátorok, ami azt jelenti, hogy felgyorsítják a reakciókat anélkül, hogy maguk átalakulnának. Ez a tulajdonság teszi őket rendkívül hatékonnyá, hiszen egyetlen enzimmolekula képes rengeteg reakciót katalizálni.
Minden enzim egyedi, és egy adott szubsztrátumra specializálódott. Ez a kulcs-zár elvhez hasonlítható: az enzim aktív centruma pontosan illeszkedik a szubsztrátumhoz, így lehetővé téve a reakció gyors és hatékony lezajlását. Az enzimek működését számos tényező befolyásolja, mint például a hőmérséklet, a pH és a szubsztrátum koncentrációja. Ezeknek a tényezőknek az optimális tartományban kell lenniük ahhoz, hogy az enzim a legaktívabb legyen.
Az enzimek szerepe a biokémiában messze túlmutat a reakciók egyszerű felgyorsításán. Részt vesznek a tápanyagok lebontásában, az energia termelésében, a DNS szintézisében és javításában, valamint a sejtek közötti kommunikációban is. Gyakorlatilag minden biokémiai folyamat enzimek által szabályozott.
Az enzimek nélkül az élet elképzelhetetlen. Ők a biokémiai folyamatok motorjai, amelyek lehetővé teszik a sejtek számára a túlélést és a működést.
A gyógyszeripar is nagy mértékben támaszkodik az enzimek ismeretére. Számos gyógyszer úgy hat, hogy gátolja egy adott enzim működését, ezáltal befolyásolva egy betegség lefolyását. Az enzimekkel kapcsolatos kutatások folyamatosan bővülnek, és újabb és újabb alkalmazási területek kerülnek felfedezésre.
Az enzimek alapvető definíciója és kémiai szerkezete
Az enzimek a biokémia nélkülözhetetlen szereplői, biokatalizátorok, amelyek felgyorsítják a kémiai reakciókat a szervezetekben. Lényegében fehérjék, bár egyes esetekben ribonukleinsavak (RNS) is betölthetnek enzim funkciót (ribozimek). A fehérje alapú enzimek aminosavakból épülnek fel, amelyek specifikus szekvenciát alkotnak, meghatározva az enzim háromdimenziós szerkezetét.
Ez a háromdimenziós szerkezet kritikus fontosságú, mivel tartalmazza az aktív centrumot, azt a régiót, ahol a szubsztrát (a reakcióba lépő molekula) kötődik, és ahol a katalitikus reakció végbemegy. Az aktív centrum alakja és kémiai tulajdonságai rendkívül specifikusak a szubsztrátra nézve, ami magyarázza az enzimek nagyfokú szelektivitását. Ezt a szubsztrát-specifikusságot gyakran a kulcs-zár elvhez hasonlítják.
Az enzimek működéséhez gyakran szükség van kofaktorokra. A kofaktorok lehetnek fémionok (pl. cink, vas, réz) vagy szerves molekulák, amelyeket koenzimeknek nevezünk (pl. vitaminok származékai). A kofaktorok segítik az enzimet a katalitikus tevékenységében, például elektronok átvitelével vagy a szubsztrát stabilizálásával.
Az enzimek alapvető definíciója szerint tehát olyan fehérjék (vagy ritkábban RNS molekulák), amelyek katalizálják a biokémiai reakciókat, azaz anélkül gyorsítják fel a reakció sebességét, hogy maguk a reakció során átalakulnának.
Fontos megjegyezni, hogy az enzimek nem változtatják meg a reakció egyensúlyi helyzetét, csak a reakcióhoz szükséges aktivációs energiát csökkentik, ezáltal gyorsítva a folyamatot. A kémiai szerkezetük komplexitása teszi lehetővé ezt a rendkívül hatékony és specifikus katalitikus tevékenységet, amely elengedhetetlen az élet fenntartásához.
Az enzimek működési mechanizmusa: kulcs-zár modell vs. indukált illeszkedés
Az enzimek működésének megértése a biokémia egyik alapköve. Két fő modell létezik, amelyek megpróbálják leírni, hogyan kapcsolódnak az enzimek a szubsztrátjaikhoz: a kulcs-zár modell és az indukált illeszkedés modell.
A kulcs-zár modell egy egyszerű, korai elképzelés. Eszerint az enzim aktív centruma egy merev, előre meghatározott forma, amely pontosan illeszkedik a szubsztrátum molekulájához, mint egy kulcs a zárba. Ez a modell könnyen elképzelhető, és segített megérteni az enzim-szubsztrát specificitást. Azonban ez a modell nem magyarázza meg az enzimek rugalmasságát és azt, hogy az enzimek hogyan tudják stabilizálni az átmeneti állapotot a reakció során.
Ezzel szemben az indukált illeszkedés modell egy dinamikusabb képet fest. Ebben a modellben az enzim aktív centruma nem teljesen merev, hanem képes formát változtatni, amikor a szubsztrátum megközelíti. A szubsztrátum kötődése az enzimhez egy konformációs változást indukál, ami optimálisan illeszti az enzimet a szubsztrátumhoz. Ez a változás nemcsak javítja a kötődést, hanem gyakran az enzim katalitikus képességét is fokozza.
Az indukált illeszkedés modell jobban tükrözi a valóságot, mivel az enzimek nem merev szerkezetek, hanem dinamikus molekulák, amelyek képesek alkalmazkodni a környezetükhöz.
Az indukált illeszkedés lehetővé teszi az enzim számára, hogy stabilizálja az átmeneti állapotot, ami kulcsfontosságú a reakció felgyorsításához. Ez az átmeneti állapot egy instabil, magas energiájú szerkezet, amely a szubsztrátumból a termékké alakulás során keletkezik. Az enzim kötődése az átmeneti állapothoz csökkenti az aktivációs energiát, ami lényegesen felgyorsítja a reakciót.
Például, a hexokináz enzim glükózhoz való kötődésekor jelentős konformációs változáson megy keresztül, ami elzárja a vízmolekulákat az aktív centrumtól, és elősegíti a glükóz foszforilációját. Ez a példa jól illusztrálja, hogy az indukált illeszkedés nem csak egy egyszerű illeszkedés, hanem egy aktív folyamat, amely hozzájárul az enzim katalitikus aktivitásához.
Az aktív centrum szerepe a szubsztrát megkötésében és a katalízisben

Az enzimek katalitikus hatásának kulcsa az aktív centrum, amely egy speciális, háromdimenziós üreg az enzim molekulájában. Itt történik a szubsztrát megkötése és a kémiai reakció lezajlása. Az aktív centrumot alkotó aminosavak oldalláncai felelősek a szubsztrát specifikus kötéséért, ami rendkívül fontos az enzim szelektivitásának biztosításában.
A szubsztrát megkötése nem csupán egy egyszerű fizikai folyamat. Az indukált illeszkedés elve szerint az enzim aktív centruma kissé megváltoztatja a formáját a szubsztrát megkötésekor, optimalizálva a kötést és elősegítve a katalízist. Ez a dinamikus folyamat maximalizálja az enzim és a szubsztrát közötti interakciókat.
A katalízis az aktív centrumban történik, ahol az aminosavak oldalláncai különböző mechanizmusok révén segítik elő a reakciót. Ezek a mechanizmusok lehetnek sav-bázis katalízis, kovalens katalízis, vagy akár fémionok bevonása is. A cél az, hogy csökkentsék a reakció aktivációs energiáját, ezáltal felgyorsítva a reakció sebességét.
Az aktív centrum nem csupán egy kötőhely, hanem egy dinamikus, katalitikusan aktív környezet, amely nélkülözhetetlen az enzim működéséhez.
Fontos megjegyezni, hogy az aktív centrum formája és kémiai tulajdonságai rendkívül érzékenyek a környezeti tényezőkre, mint például a pH és a hőmérséklet. Az optimális körülmények biztosítják az enzim maximális aktivitását. A nem megfelelő körülmények denaturációhoz vezethetnek, ami az enzim működésképtelenségét eredményezi.
Az enzimek aktív centrumának részletes megértése elengedhetetlen a biokémiai folyamatok irányításához és a gyógyszerfejlesztéshez. A gyógyszerek gyakran az enzim aktív centrumához kötődnek, blokkolva annak működését és ezáltal befolyásolva a biológiai folyamatokat.
Kofaktorok és koenzimek: az enzimek segítői
Az enzimek, bár önmagukban is lenyűgöző katalizátorok, gyakran nem tudnak teljes mértékben működni segítők nélkül. Ezek a segítők a kofaktorok és koenzimek. Gondoljunk rájuk úgy, mint az enzimek „szerszámaira”, amelyek nélkül nem tudnák elvégezni a feladatukat.
A kofaktorok általában fémionok, például vas, cink vagy magnézium. Ezek az ionok közvetlenül részt vehetnek a katalitikus reakcióban, stabilizálhatják az enzim szerkezetét, vagy segíthetnek a szubsztrát kötődésében.
A koenzimek viszont szerves molekulák, gyakran vitaminokból származnak. Például a NAD+ (nikotinamid-adenin-dinukleotid) egy fontos koenzim, amely számos redoxireakcióban vesz részt, elektronokat szállítva egyik molekuláról a másikra.
A kofaktorok és koenzimek esszenciálisak az enzimek megfelelő működéséhez, mivel lehetővé teszik számukra olyan kémiai reakciók katalizálását, amelyekre az enzim fehérje része önmagában nem lenne képes.
A kofaktorok és koenzimek kötődése az enzimhez lehet szoros (prosztetikus csoport), vagy laza és átmeneti. A lényeg, hogy nélkülük az enzim inaktív, vagy jelentősen csökkent aktivitást mutat.
Fontos megjegyezni, hogy a táplálkozásunk során bevitt vitaminok és ásványi anyagok gyakran kofaktorok és koenzimek előanyagai, ezért is létfontosságú a változatos és kiegyensúlyozott étrend.
Enzimkinetika: a reakciósebesség mérése és a Michaelis-Menten egyenlet
Az enzimkinetika az enzimek működésének sebességével foglalkozó tudományág. Lényegében azt vizsgáljuk, hogy mennyire gyorsan katalizálnak egy-egy reakciót az enzimek, és ezt milyen tényezők befolyásolják. A reakciósebesség mérése kulcsfontosságú ahhoz, hogy megértsük az enzimek működési mechanizmusát és szabályozását.
A reakciósebesség méréséhez általában a termék képződésének sebességét vagy a szubsztrát fogyásának sebességét követjük nyomon idő függvényében. Ezt spektrofotometriás módszerekkel, vagy más analitikai eljárásokkal végezzük. A kapott adatokból aztán meghatározhatjuk a kezdeti reakciósebességet (V0), ami a reakció kezdeti szakaszában mért sebesség, amikor a termék koncentrációja még elhanyagolható.
A Michaelis-Menten egyenlet egy alapvető modell az enzimkinetikában, ami leírja az enzimreakciók sebességét a szubsztrát koncentráció függvényében. Az egyenlet a következő:
V = (Vmax * [S]) / (Km + [S])
Ahol:
- V a reakciósebesség
- Vmax a maximális reakciósebesség (amikor az enzim teljes mértékben telített szubsztráttal)
- [S] a szubsztrát koncentrációja
- Km a Michaelis-állandó, ami megmutatja, hogy mekkora szubsztrát koncentráció szükséges a Vmax felének eléréséhez. A Km egy fontos jellemzője az enzimnek, megmutatja, hogy milyen affinitással kötődik az enzim a szubsztráthoz. Alacsony Km magas affinitást, magas Km alacsony affinitást jelent.
Az Michaelis-Menten egyenlet alapvető fontosságú, mert segít megérteni, hogy a szubsztrát koncentrációja hogyan befolyásolja az enzim reakciósebességét, és lehetővé teszi az enzimek kinetikai paramétereinek (Vmax és Km) meghatározását.
A Michaelis-Menten görbe egy hiperbola, ami a V0-t ábrázolja a [S] függvényében. Alacsony szubsztrát koncentrációknál a reakciósebesség lineárisan növekszik a szubsztrát koncentrációjával. Magas szubsztrát koncentrációknál viszont a reakciósebesség eléri a Vmax-ot, és már nem nő tovább a szubsztrát koncentrációjának növelésével, mert az enzim telítetté válik.
A Michaelis-Menten egyenletnek számos korlátozása is van. Például, feltételezi, hogy a reakció egyensúlyi állapotban van, és hogy az enzimnek csak egy aktív helye van. Valós enzimek esetében a helyzet sokkal bonyolultabb lehet, de az egyenlet mégis egy hasznos kiindulópont az enzimkinetikai vizsgálatokhoz.
A Michaelis-Menten állandó (Km) és a maximális reakciósebesség (Vmax) értelmezése
Az enzimek működésének megértéséhez elengedhetetlen a Michaelis-Menten állandó (Km) és a maximális reakciósebesség (Vmax) fogalmának ismerete. A Km az a szubsztrát koncentráció, amelynél a reakciósebesség a maximális sebesség felét éri el. Alacsony Km érték azt jelenti, hogy az enzim nagy affinitással rendelkezik a szubsztráthoz, azaz már kis koncentrációban is hatékonyan katalizálja a reakciót. Magas Km érték viszont alacsonyabb affinitást jelez, ilyenkor nagyobb szubsztrát koncentráció szükséges a maximális sebesség felének eléréséhez.
A Vmax az a maximális sebesség, amelyet az enzim elérhet, ha teljesen telített szubsztráttal. Ez az érték az enzim koncentrációjától függ – minél több enzim van jelen, annál nagyobb lehet a Vmax. A Vmax nem az enzim szubsztráthoz való affinitását tükrözi, hanem a katalitikus hatékonyságát nagy szubsztrát koncentrációk esetén.
A Km tehát az enzim szubsztrátkötési képességének a mérőszáma, míg a Vmax az enzim katalitikus aktivitásának a maximumát jelzi.
A Km és Vmax értékek ismerete kulcsfontosságú az enzimek működésének szabályozásában és az enzim inhibitorok hatásmechanizmusának megértésében. Például egy kompetitív inhibitor növeli a látszólagos Km-et, de nem befolyásolja a Vmax-ot, míg egy nem-kompetitív inhibitor csökkenti a Vmax-ot, de a Km-et nem változtatja meg jelentősen. Ezek az értékek segítenek megérteni, hogyan befolyásolják különböző molekulák az enzim működését és ezáltal a biokémiai folyamatokat.
Enzimgátlás: kompetitív, nem-kompetitív és unkompetitív gátlás
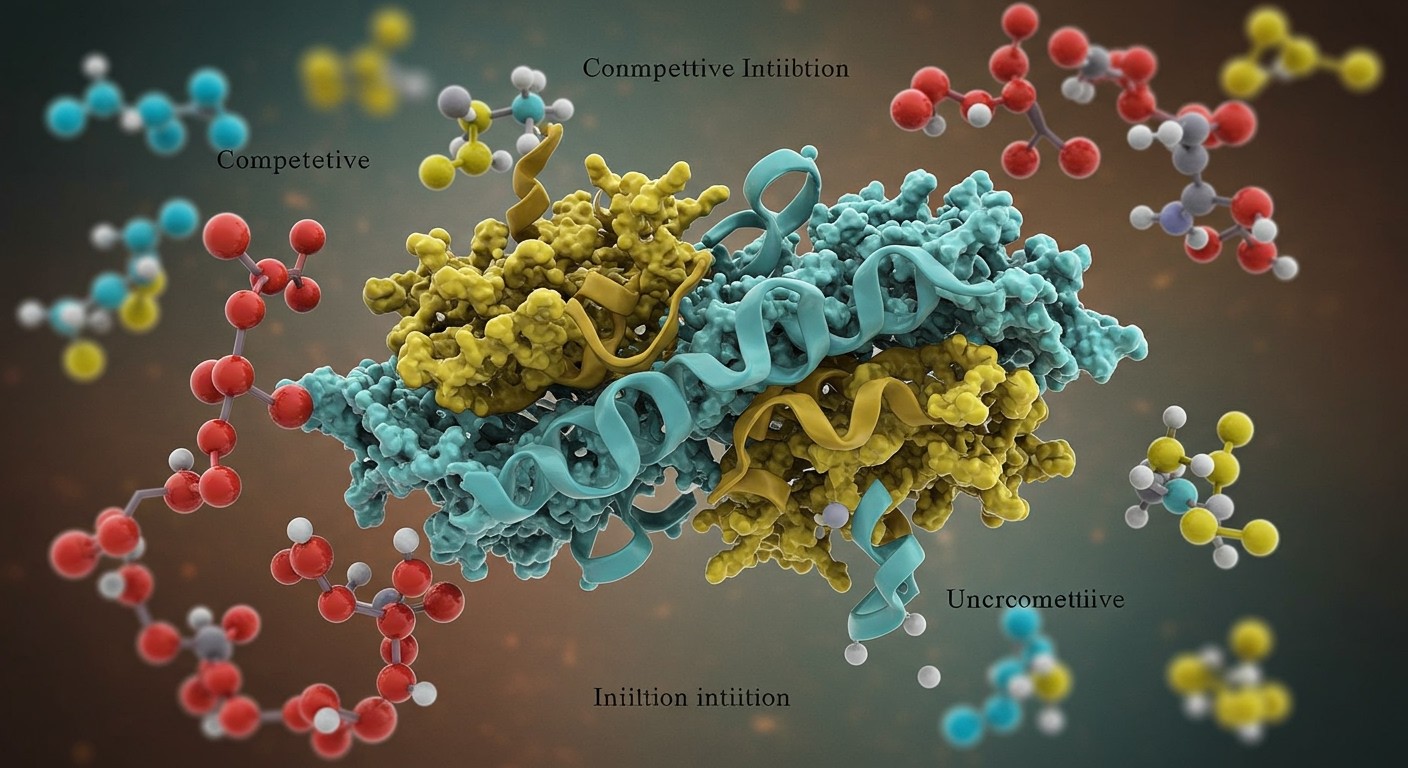
Az enzimek működésének egyik kulcsfontosságú szabályozási módja az enzimgátlás. Ez azt jelenti, hogy bizonyos molekulák megakadályozzák vagy lassítják az enzim katalitikus aktivitását. Három fő típust különböztetünk meg: kompetitív, nem-kompetitív és unkompetitív gátlást.
A kompetitív gátlás során a gátló molekula (inhibitor) az enzim aktív helyéért verseng a szubsztráttal. Mivel az inhibitor hasonlít a szubsztrátra, képes kötődni az aktív helyhez, de nem katalizálódik, így blokkolja a szubsztrát kötődését. A kompetitív gátlás hatása csökkenthető a szubsztrát koncentrációjának növelésével, mivel ezáltal nagyobb valószínűséggel kötődik a szubsztrát az enzimhez, mint a gátló molekula.
A nem-kompetitív gátlás esetében a gátló molekula az enzim egy másik pontjához (nem az aktív helyhez) kötődik, és ezzel megváltoztatja az enzim alakját, ami csökkenti az enzim aktivitását. Ebben az esetben a gátló molekula kötődése nem befolyásolja a szubsztrát kötődését, de a katalitikus reakció sebessége lelassul. A szubsztrát koncentrációjának növelése nem befolyásolja a nem-kompetitív gátlást.
Az unkompetitív gátlás egy harmadik típusú gátlás, ahol a gátló molekula csak az enzim-szubsztrát komplexhez kötődik. Ez a kötődés tovább torzítja az enzim alakját és megakadályozza a termék képződését. Az unkompetitív gátlás különösen fontos lehet több szubsztrátot igénylő enzimreakciók esetében.
Az enzimgátlás létfontosságú szerepet játszik a biokémiai folyamatok szabályozásában, lehetővé téve a sejtek számára, hogy finomhangolják az anyagcsere útvonalait és reagáljanak a változó környezeti feltételekre.
Az enzimgátlás nem csak a sejt belső szabályozásában fontos, hanem számos gyógyszer alapját is képezi. Sok gyógyszer úgy működik, hogy gátolja egy bizonyos enzim aktivitását, ezáltal befolyásolva egy betegség lefolyását. Például, egyes antibiotikumok bakteriális enzimeket gátolnak, amelyek a baktériumok szaporodásához szükségesek.
Alloszterikus enzimek és a szabályozásuk
Az alloszterikus enzimek különleges helyet foglalnak el az enzimvilágban, hiszen nemcsak katalizálják a reakciókat, hanem szabályozhatóak is. Ez azt jelenti, hogy aktivitásuk növelhető vagy csökkenthető más molekulák, úgynevezett alloszterikus modulátorok kötődésével.
Ezek a modulátorok nem a szokásos aktív helyhez kötődnek, hanem egy külön, alloszterikus helyhez. Kötődésük konformációs változást idéz elő az enzimben, ami befolyásolja az aktív hely formáját és ezáltal az enzim katalitikus aktivitását. A modulátorok lehetnek aktivátorok, melyek növelik az enzim aktivitását, vagy inhibitorok, melyek csökkentik azt.
Az alloszterikus enzimek szabályozása kulcsfontosságú a metabolikus útvonalak finomhangolásában, lehetővé téve a sejtek számára, hogy gyorsan reagáljanak a változó környezeti feltételekre és igényekre.
A szabályozás gyakran visszacsatolási mechanizmuson keresztül történik, ahol a metabolikus útvonal végterméke alloszterikusan gátolja az útvonal elején lévő enzimet. Így a sejt elkerüli a végtermék túlzott felhalmozódását. Az alloszterikus enzimek általában több alegységből állnak, és a modulátorok kötődése kooperatív hatást válthat ki, ami azt jelenti, hogy egy modulátor kötődése megkönnyíti a többi modulátor kötődését is.
A pH és a hőmérséklet hatása az enzimaktivitásra
Az enzimek aktivitása rendkívül érzékeny a környezeti tényezőkre, különösen a pH-ra és a hőmérsékletre. Mindkét tényező jelentősen befolyásolja az enzim térszerkezetét, és ezáltal a katalitikus képességét.
A pH hatása abban rejlik, hogy az enzimek aminosav oldalláncai ionizálhatók, vagyis protonokat vehetnek fel vagy adhatnak le. A megfelelő ionizációs állapot kritikus a szubsztrát megkötéséhez és a katalízishez. Minden enzimnek van egy optimális pH-ja, ahol a legaktívabb. Ha a pH eltér ettől az optimális tartománytól, az enzim denaturálódhat, elveszítve a funkcióját.
A hőmérséklet is hasonlóan fontos. A hőmérséklet emelkedésével az enzimaktivitás általában nő, mivel a molekulák kinetikus energiája is növekszik, ami gyakoribb ütközéseket eredményez a szubsztrát és az enzim aktív centruma között. Azonban egy bizonyos hőmérséklet felett az enzim szerkezete instabillá válik, és denaturálódik. A denaturáció során az enzim elveszíti a háromdimenziós szerkezetét, és így a katalitikus képességét is.
Az enzimek optimális pH-ja és hőmérséklete nagymértékben függ az enzim eredetétől és a szervezet fiziológiás körülményeitől.
Például, az emberi testben működő enzimek optimális hőmérséklete általában 37°C körül van, míg a gyomorsavban működő pepszin optimális pH-ja nagyon savas, 2 körül van. Ezzel szemben, a vékonybélben található enzimeknek lúgosabb pH-ra van szükségük a hatékony működéshez.
Az enzimek szerepe az anyagcsere-útvonalakban
Az enzimek nem csupán egyedi reakciókat katalizálnak, hanem kulcsszerepet játszanak az anyagcsere-útvonalakban, amelyek a sejtek életének alapját képezik. Ezek az útvonalak egymásra épülő, szekvenciális kémiai reakciók sorozatai, melyek egy kiindulási molekulát fokozatosan alakítanak át egy vagy több végtermékké.
Gondoljunk egy gyártósorra: minden állomáson egy munkás (az enzim) elvégzi a saját feladatát, átadva a munkadarabot (a molekulát) a következő állomásnak. Az enzimek ebben a sorban mindegyike specifikusan katalizál egyetlen lépést, így biztosítva, hogy az útvonal zökkenőmentesen és hatékonyan működjön. Például, a glikolízis, a glükóz lebontásának folyamata, tíz különböző enzimet igényel, melyek mindegyike egy-egy specifikus reakciót gyorsít fel.
Az enzimek szabályozása az anyagcsere-útvonalak finomhangolásának alapvető eszköze. A sejtek képesek aktiválni vagy gátolni bizonyos enzimeket, attól függően, hogy éppen milyen anyagcsere-szükségleteik vannak. Ez a szabályozás történhet alloszterikus szabályozással (amikor egy molekula az enzim egy távoli pontjához kötődve megváltoztatja annak aktivitását), vagy kovalens módosítással (például foszforilációval).
Az enzimek aktivitásának szabályozása az anyagcsere-útvonalakban lehetővé teszi a sejtek számára, hogy dinamikusan reagáljanak a környezeti változásokra és fenntartsák a homeosztázist.
Hibák az enzimfunkcióban, például genetikai mutációk következtében, súlyos anyagcsere-betegségekhez vezethetnek. Például a fenilketonuria (PKU) egy olyan genetikai rendellenesség, amelyben a fenil-alanin hidroxiláz enzim nem működik megfelelően, ami a fenil-alanin felhalmozódásához vezet a szervezetben, és károsíthatja az idegrendszert.
Az enzimek tehát nem csupán biokatalizátorok, hanem az anyagcsere-útvonalak irányítói és szabályozói, melyek nélkül a sejtek nem lennének képesek az élethez szükséges energiát előállítani és a biomolekulákat szintetizálni.
A glikolízis enzimjei és szabályozása

A glikolízis, a glükóz lebontásának kulcsfontosságú folyamata, számos enzim gondosan koordinált munkáján alapul. Ezek az enzimek katalizálják a glükóz tíz lépéses átalakulását piruváttá, energia (ATP és NADH) felszabadítása mellett. Kiemelkedő enzimek közé tartozik a hexokináz, mely a glükóz foszforilációját végzi, ezzel „csapdába ejtve” a sejten belül. A foszfofruktokináz-1 (PFK-1) a legfontosabb szabályozó enzim, alloszterikusan szabályozott ATP, AMP és citrát által.
A piruvát-kináz az utolsó, ATP-termelő lépést katalizálja, és szintén fontos szabályozási pont. Aktiválja az inzulin, míg gátolja az ATP és alanin. A glikolízis enzimeinek aktivitása szigorúan szabályozott a sejt energiaszintjének megfelelően. Ha magas az ATP szint, a glikolízis lassul, míg alacsony ATP szint esetén felgyorsul.
A PFK-1 aktivitásának szabályozása kulcsfontosságú a glikolízis sebességének beállításához, és ezáltal az energiatermelés optimalizálásához a sejt igényei szerint.
A májban a glükokináz a hexokináz speciális formája, magasabb Km értékkel, ami azt jelenti, hogy csak magas glükóz koncentráció esetén aktív, lehetővé téve a máj számára a felesleges glükóz raktározását.
A citrátkör enzimjei és szabályozása
A citrátkör, más néven Krebs-ciklus, egy központi anyagcsereút, melynek során számos enzim működik együtt a glükóz, zsírsavak és aminosavak lebontásából származó acetil-CoA oxidációjában. Ezek az enzimek katalizálják a ciklus nyolc egymást követő reakcióját, melynek eredményeként ATP (vagy GTP), NADH és FADH2 keletkezik.
A ciklus első enzime a citrát-szintáz, mely az oxálacetátból és acetil-CoA-ból citrátot állít elő. Ezt követi az akonitáz, mely izocitrátot képez. Az izocitrát-dehidrogenáz az izocitrátból α-ketoglutaráttá alakít át, miközben CO2 és NADH keletkezik. Ezt követően az α-ketoglutarát-dehidrogenáz komplex (hasonló a piruvát-dehidrogenáz komplexhez) szukcinil-CoA-t hoz létre, szintén CO2 és NADH felszabadulásával.
A szukcinil-CoA-szintetáz szukcinátot képez GTP (vagy ATP) felhasználásával, majd a szukcinát-dehidrogenáz fumarátot állít elő FADH2 keletkezése közben. A fumarát-hidratáz (fumaráz) fumarátot alakít maláttá, végül a malát-dehidrogenáz malátból oxálacetátot regenerálja, NADH keletkezése mellett.
A citrátkör szabályozása több ponton történik, elsősorban az enzimek alloszterikus szabályozásán keresztül. Az ATP, NADH és szukcinil-CoA általában gátolják a ciklus enzimeit, míg az ADP és AMP aktiválják őket. A kalciumionok is fontos szerepet játszanak egyes enzimek, például az izocitrát-dehidrogenáz aktiválásában.
A citrátkör szabályozása kulcsfontosságú a sejt energiaszintjének fenntartásához és az anabolikus folyamatok szubsztrátjainak biztosításához.
Az oxidatív foszforiláció enzimkomplexei
Az oxidatív foszforiláció, a sejtlégzés utolsó szakasza, az enzimek komplex együttműködésén alapul. Négy nagyméretű fehérjekomplex (I-IV) és az ATP-szintáz (V. komplex) alkotják a mitokondrium belső membránjában elhelyezkedő elektronszállító láncot. Ezek a komplexek szigorúan szabályozott módon továbbítják az elektronokat a NADH-ból és FADH2-ből származó energiát felhasználva protonok (H+) pumpálására a mitokondriális mátrixból a membránok közötti térbe.
Az I. komplex (NADH-koenzim Q reduktáz) a NADH-ból veszi fel az elektronokat és a koenzim Q-nak (ubikinon) adja át. A II. komplex (szukcinát-koenzim Q reduktáz) a citrátkörből származó FADH2-ből származó elektronokat juttatja a koenzim Q-hoz. A III. komplex (koenzim Q-citokróm c reduktáz) a koenzim Q-ból veszi fel az elektronokat és a citokróm c-nek adja át. A IV. komplex (citokróm c oxidáz) a citokróm c-ből veszi fel az elektronokat és oxigénre adja át, vizet képezve.
A protonok membránok közötti térbe pumpálása egy elektrokémiai gradienset hoz létre, melynek energiája az ATP-szintáz által ATP szintéziséhez használható fel.
Az ATP-szintáz egy molekuláris motor, mely a protonok gradiensének energiáját használja fel ADP-ből és foszfátból ATP előállításához. A folyamat rendkívül hatékony, és a sejtek energiaellátásának kulcsfontosságú eleme. Az egyes komplexek hibái súlyos betegségekhez vezethetnek, hangsúlyozva az enzimek létfontosságú szerepét a biokémiában és az életben.
Az enzimek szerepe a DNS replikációban és javításban
A DNS replikáció és javítás folyamatai elképzelhetetlenek lennének enzimek nélkül. Ezek a biokatalizátorok biztosítják a genetikai információ pontos másolását és a felmerülő hibák korrigálását, ezzel garantálva a sejtek stabilitását és a fajok fennmaradását.
A replikáció során a DNS polimeráz kulcsszerepet játszik. Ez az enzim a meglévő DNS szálat sablonként használva építi fel az új, komplementer szálat. Fontos megjegyezni, hogy a DNS polimeráz csak egy irányba képes a szálat szintetizálni, ami a replikációs villa „lemaradó” szálánál (lagging strand) szakaszos replikációhoz vezet. Itt a DNS ligáz lép be a képbe, összekapcsolva az egyes szakaszokat (Okazaki fragmentumokat) egy folytonos szálat képezve.
A replikáció pontossága nem tökéletes, ezért javító mechanizmusokra van szükség. A proofreading funkció, mely a DNS polimerázhoz kapcsolódik, felismeri és kijavítja a rosszul beépített nukleotidokat. Más enzimek, mint például a nukleázok, eltávolítják a sérült vagy módosult DNS szakaszokat, melyeket aztán a DNS polimeráz és a DNS ligáz helyreállítanak.
A DNS replikáció és javítás enzimeinek hibátlan működése alapvető fontosságú a mutációk minimalizálásához és a genetikai stabilitás fenntartásához.
Számos más enzim is részt vesz ezekben a folyamatokban, mint például a helikáz, ami a DNS kettős hélixét bontja ki, vagy a topoizomeráz, ami a DNS csavarodásából adódó feszültséget oldja fel. Ezek az enzimek szinergikusan működve biztosítják a genetikai információ integritását.
A transzkripció és transzláció enzimjei
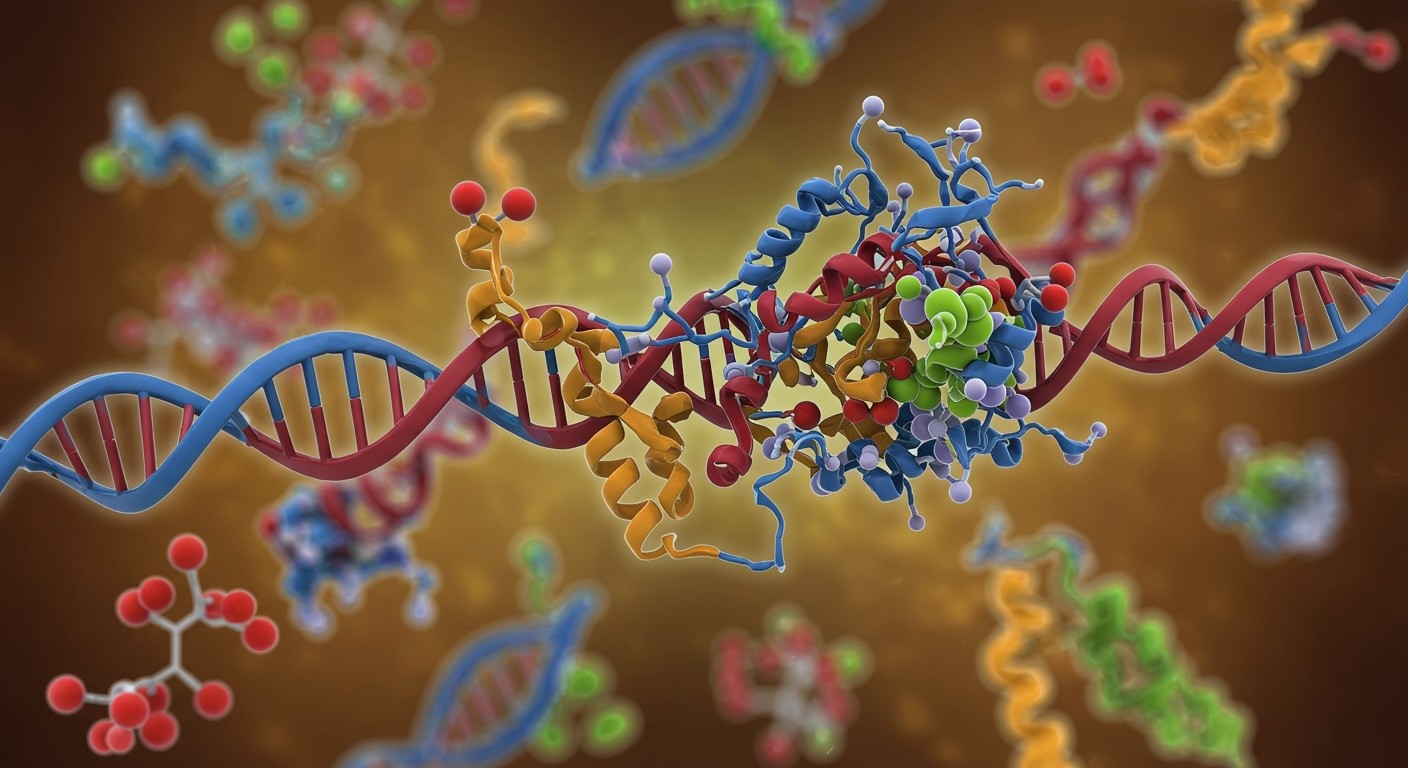
A transzkripció és transzláció, a genetikai információ átírásának és lefordításának kulcsfontosságú folyamatai, elképzelhetetlenek lennének a megfelelő enzimek nélkül. A transzkripció során a DNS-ről mRNS (messenger RNS) másolat készül. Ebben a folyamatban a legfontosabb enzim a DNS-dependens RNS-polimeráz, amely a DNS szálat templátként használva szintetizálja az mRNS-t. Számos egyéb enzim is közreműködik, például a helikázok, amelyek a DNS kettős spirálját felcsavarják, lehetővé téve a polimeráz hozzáférését.
A transzláció, vagyis a fehérjeszintézis a riboszómákban zajlik. Itt a tRNS (transzfer RNS) molekulák szállítják az aminosavakat a riboszómához, az mRNS kódjai alapján. Az aminoacil-tRNS szintetázok kulcsfontosságúak, mert biztosítják, hogy minden tRNS a megfelelő aminosavhoz kapcsolódjon.
A transzkripció és transzláció enzimjeinek hibátlan működése elengedhetetlen a sejt egészséges működéséhez, mivel ezek az enzimek felelősek a genetikai kód pontos átírásáért és lefordításáért, ami a fehérjék helyes szintéziséhez vezet.
Ezeken túl riboszomális fehérjék és RNS molekulák (a riboszóma alkotói) is részt vesznek a folyamatban, katalizálva a peptidkötések kialakulását az aminosavak között, létrehozva a polipeptidláncot. A transzláció során számos faktor is részt vesz, például iniciációs, elongációs és terminációs faktorok, amelyek a folyamat elindításában, meghosszabbításában és befejezésében játszanak szerepet. Az enzimek hiánya vagy hibás működése súlyos betegségekhez vezethet.
Az enzimek szerepe az emésztésben
Az emésztés során a táplálékban található nagy molekulákat kisebb, felszívódásra alkalmas egységekre kell bontani. Ebben a folyamatban kulcsszerepet játszanak az enzimek. Ezek a biokatalizátorok felgyorsítják a kémiai reakciókat anélkül, hogy maguk átalakulnának. Az emésztőrendszer különböző szakaszaiban különböző enzimek fejtik ki hatásukat, mindegyikük specifikus a lebontandó molekula típusára.
A szájüregben a amiláz kezdi meg a keményítő bontását cukrokká. A gyomorban a pepszin a fehérjéket peptidekké hasítja. A vékonybélben a hasnyálmirigy által termelt enzimek – mint a tripszin, kimotripszin és karboxipeptidáz – folytatják a fehérjék lebontását, míg a lipáz a zsírokat zsírsavakká és glicerinné alakítja. A vékonybél falában található enzimek, mint a maltáz, szukráz és laktáz, a diszacharidokat (pl. maltóz, szukróz, laktóz) egyszerű cukrokká bontják.
Az enzimek hiánya vagy elégtelen működése emésztési problémákhoz vezethet. Például a laktáz enzim hiánya laktózintoleranciát okoz, ami kellemetlen tünetekkel járhat tejtermékek fogyasztása után.
Az enzimek nélkül az emésztés folyamata rendkívül lassú lenne, és a szervezet nem tudna hatékonyan hozzájutni a tápanyagokhoz.
Tehát, az enzimek az emésztés nélkülözhetetlen elemei, biztosítva a táplálék hatékony feldolgozását és a szükséges tápanyagok felszívódását.
Proteázok: a fehérjék bontásának mesterei
A proteázok, más néven peptidázok, a fehérjék lebontásának kulcsfontosságú enzimjei. Ezek a molekuláris ollók specifikusan a peptidkötéseket hasítják, melyek az aminosavakat kapcsolják össze a fehérjeláncokban. Ezzel a folyamattal a nagy, komplex fehérjéket kisebb peptidekre vagy szabad aminosavakra bontják, melyek aztán felhasználhatók új fehérjék szintéziséhez vagy energiaforrásként szolgálhatnak.
A proteázok rendkívül sokoldalúak, és számos biológiai folyamatban játszanak nélkülözhetetlen szerepet. Ilyenek például az emésztés (ahol a táplálék fehérjéit bontják le), a véralvadás, az immunválasz szabályozása, a sejtek növekedése és differenciálódása, valamint a sejtek halála (apoptózis). A proteázok működése rendkívül specifikus lehet, egyesek csak bizonyos aminosav-szekvenciák közelében képesek hasítani a peptidkötéseket, míg mások kevésbé válogatósak.
A proteázok nélkülözhetetlenek a fehérjék szabályozott lebontásához, ami kritikus fontosságú a sejtek homeosztázisának fenntartásához és a károsodott vagy felesleges fehérjék eltávolításához.
Számos proteáz gátlószerrel szabályozható, ami lehetővé teszi a szervezet számára, hogy pontosan kontrollálja ezeknek az enzimeknek a tevékenységét. A proteáz inhibitorok fontos szerepet játszanak a gyógyszerkutatásban is, hiszen számos betegség, például a rák és a gyulladásos betegségek kezelésében potenciális célpontok.
Amilázok: a szénhidrátok emésztésének kulcsenzimei
Az amilázok a szénhidrátok lebontásának nélkülözhetetlen enzimei. Két fő típusa létezik: a nyálamiláz (más néven ptialin), amely a szájüregben kezdi meg a keményítő bontását, és a hasnyálmirigy-amiláz, amely a vékonybélben folytatja ezt a folyamatot.
Mindkét amiláz a keményítőt és más komplex szénhidrátokat egyszerűbb cukrokká, például maltózzá és glükózzá bontja. Ez a lebontás azért fontos, mert a szervezet csak az egyszerű cukrokat képes felszívni és energiaként hasznosítani.
Az amilázok katalizálják a keményítő hidrolízisét, azaz vízzel bontják a glükózmolekulák közötti kötéseket, ezáltal segítve a táplálékból származó szénhidrátok emésztését.
Az amilázok aktivitásának mérése fontos diagnosztikai eszköz is lehet. A vérben vagy vizeletben mért magas amilázszint például a hasnyálmirigy gyulladására (pancreatitis) utalhat. Az amilázok tehát nem csupán emésztőenzimek, hanem kulcsfontosságú szerepet töltenek be a szénhidrát-anyagcsere szabályozásában és a betegségek diagnosztizálásában is.
Lipázok: a zsírok emésztésének elengedhetetlen résztvevői

A lipázok egy speciális enzimcsoportot képviselnek, amelyek a zsírok (trigliceridek) hidrolíziséért felelősek. Ez a folyamat kulcsfontosságú az emésztés során, hiszen a nagy, vízben nem oldódó zsírmolekulákat kisebb, könnyebben felszívódó komponensekre, például zsírsavakra és glicerinre bontják.
A lipázok nem csak az emésztőrendszerben találhatók meg. Szerepet játszanak a vérben szállított lipoproteinek metabolizmusában, a zsírszövetekben történő zsírraktározásban és -felszabadításban, valamint a sejtmembránok szerkezetének fenntartásában is. Különböző típusú lipázok léteznek, amelyek specifikus zsírsavak hasítására specializálódtak.
A lipázok nélkül a szervezet képtelen lenne hatékonyan feldolgozni a zsírokat, ami tápanyaghiányhoz és egyéb egészségügyi problémákhoz vezethetne.
A lipázok aktivitását számos tényező befolyásolja, többek között a pH-érték, a hőmérséklet és a kofaktorok jelenléte. Például a hasnyálmirigy által termelt lipáz működéséhez kolipáz nevű proteinre van szükség, amely elősegíti a lipáz kapcsolódását a zsírcseppekhez.
Az enzimek orvosi alkalmazásai: diagnosztika és terápia
Az enzimek nem csupán a biokémiai folyamatok katalizátorai, hanem a modern orvostudomány kulcsfontosságú eszközei is. Diagnosztikai és terápiás alkalmazásuk egyre szélesebb körben terjed, köszönhetően specifikusságuknak és hatékonyságuknak.
Diagnosztikában az enzimeket elsősorban biomarkerként használják. Bizonyos enzimek szintjének emelkedése a vérben vagy más testnedvekben specifikus betegségekre utalhat. Például, a szívinfarktus diagnosztizálásában a troponin és a kreatin-kináz (CK) enzimek szintjének mérése elengedhetetlen. A májbetegségek felismerésében az ALT (alanin-aminotranszferáz) és AST (aszpartát-aminotranszferáz) enzimek szintje ad értékes információt.
Terápiás célokra az enzimeket közvetlenül gyógyszerként alkalmazzák.
Az egyik legfontosabb terápiás alkalmazás az enzimpótló terápia, melyet olyan genetikai betegségek kezelésére használnak, ahol egy adott enzim nem termelődik elegendő mennyiségben, vagy egyáltalán nem termelődik.
Például a Gaucher-kór kezelésére glukocerebrozidázt adnak a betegeknek. Emellett, az enzimeket a rákellenes terápiában is alkalmazzák, például az aszparagináz az akut limfoblasztos leukémia kezelésében játszik fontos szerepet, lebontva az aszparagint, ami a rákos sejtek növekedéséhez szükséges.
Az enzimterápia területén folyó kutatások folyamatosan új lehetőségeket tárnak fel, beleértve a célzott enzimterápiákat és az enzim alapú gyógyszerfejlesztéseket.
Enzimhiány okozta betegségek: példák és kezelési lehetőségek
Az enzimhiány okozta betegségek akkor alakulnak ki, amikor egy vagy több enzim nem termelődik elegendő mennyiségben, nem működik megfelelően, vagy egyáltalán nem termelődik. Ez a metabolikus útvonalak zavarához vezet, mivel a kulcsfontosságú reakciók nem tudnak végbemenni. Számos ilyen betegség létezik, melyek genetikailag öröklődnek.
Egy klasszikus példa a fenilketonuria (PKU), ahol a fenil-alanin hidroxiláz enzim hiánya következtében a fenil-alanin felhalmozódik a szervezetben. Kezelés nélkül ez súlyos idegrendszeri károsodáshoz vezethet. A kezelés alapja a szigorú étrendi megszorítás, alacsony fenil-alanin tartalmú étrenddel.
Egy másik példa a laktózintolerancia, ahol a laktáz enzim hiánya miatt a laktóz, a tejcukor nem tud megfelelően lebomlani. Ez emésztési problémákat okoz. A kezelés itt is elsősorban étrendi, a laktóztartalmú ételek kerülése, vagy laktáz enzimet tartalmazó készítmények szedése.
A kezelési lehetőségek széles skálán mozognak, az étrendi változtatásoktól kezdve az enzim pótlásán át a génterápiáig, attól függően, hogy melyik enzim érintett és milyen súlyos a hiány.
Egyes ritkább enzimhiányok esetén, mint például a Gaucher-kór, az enzim pótló terápia (ERT) jelenthet megoldást, ahol a hiányzó enzimet intravénásan juttatják a szervezetbe. A jövőben a génterápia ígéretes lehetőség lehet az enzimhiány okozta betegségek végleges gyógyítására.
Az enzimek biotechnológiai felhasználása: ipari alkalmazások
Az enzimek nem csupán a sejtekben zajló reakciók katalizátorai, hanem a biotechnológia nélkülözhetetlen eszközei is. Széles körben alkalmazzák őket az iparban, a mosóporoktól kezdve az élelmiszergyártáson át a gyógyszeriparig.
Az élelmiszeriparban például az amiláz enzimek a keményítőt bontják le cukrokká, ami elengedhetetlen a sörgyártásban és a kenyér készítésében. A pektináz enzimeket gyümölcslevek tisztítására használják, növelve azok átlátszóságát és csökkentve a viszkozitásukat. A tejiparban a rennin enzim a tej alvadását segíti elő, ami a sajtkészítés alapja.
A mosóporokba kevert enzimek, mint a proteázok és a lipázok, hatékonyan távolítják el a fehérje- és zsíralapú szennyeződéseket alacsony hőmérsékleten is, ezzel energiát takarítva meg és kímélve a textíliákat.
Az enzimek ipari alkalmazása nemcsak hatékony, hanem gyakran környezetbarát alternatívát is kínál a hagyományos kémiai eljárásokkal szemben, mivel általában enyhébb reakciókörülményeket igényelnek és kevesebb mellékterméket generálnak.
A gyógyszeriparban az enzimeket gyógyszerhatóanyagok előállítására, diagnosztikai tesztek fejlesztésére és terápiás célokra is használják. Például a penicillin-aciláz enzim fontos szerepet játszik a félszintetikus penicillin származékok előállításában. Az enzimekkel végzett folyamatok gyakran szelektívebbek és hatékonyabbak, mint a hagyományos kémiai szintézisek.
Enzimek a mosóporokban és más háztartási termékekben
Az enzimek nem csak a szervezetünkben végzik áldásos tevékenységüket! A háztartásban is találkozhatunk velük, leggyakrabban a mosóporokban. Itt a céljuk a szennyeződések lebontása, sokkal hatékonyabban, mint a hagyományos mosószerek.
Például, a proteázok a fehérje alapú foltokat (vér, tojás, tej) bontják le, míg az amilázok a keményítő tartalmú szennyeződéseket (szószok, tészta) távolítják el. A lipázok pedig a zsírokkal birkóznak meg. Ezek az enzimek alacsony hőmérsékleten is működnek, így energiát takaríthatunk meg a mosás során.
A mosóporokban található enzimek lehetővé teszik, hogy alacsonyabb hőmérsékleten is hatékonyan távolítsuk el a szennyeződéseket, ezzel kímélve a textíliákat és a környezetet.
De nem csak mosóporokban találkozhatunk velük! Léteznek enzimes tisztítószerek is, amelyek a lefolyók eldugulását okozó szerves anyagokat bontják le, vagy a kellemetlen szagokat semlegesítik. Fontos azonban, hogy ezeket a termékeket a használati utasításnak megfelelően alkalmazzuk, hiszen az enzimek működése is függ a környezeti feltételektől (pl. pH, hőmérséklet).
Enzimek az élelmiszeriparban: erjesztés, sajtkészítés, stb.
Az enzimek az élelmiszeriparban kulcsszerepet játszanak, lehetővé téve számos hagyományos és modern technológia alkalmazását. Gondoljunk csak az erjesztésre: a sörgyártásban az amiláz enzimek a keményítőt cukrokká bontják, amit a sörélesztő alkoholos erjesztéssel alkohollá alakít. A borászatban a szőlőben természetesen jelenlévő enzimek, vagy hozzáadott enzimek segítik a szín és aromaanyagok kinyerését, valamint a stabilizálást.
A sajtkészítés egy másik kiváló példa. A tej alvadását a kimozin (chymosin) enzim idézi elő, ami a tejben található kazein fehérjét hasítja, így a tej alvadékká válik. Régebben ezt az enzimet állati gyomorból nyerték, ma már mikrobiális forrásokból is előállítják.
A sütőiparban is elengedhetetlenek az enzimek. Az amilázok a lisztben található keményítőt cukrokká bontják, ami táplálékot biztosít az élesztő számára, így a tészta megkel. Emellett javítják a kenyér állagát és frissességét.
Az enzimek használata lehetővé teszi az élelmiszerek tulajdonságainak célzott módosítását, javítva azok minőségét, eltarthatóságát és tápértékét.
De ne feledkezzünk meg a gyümölcslevek tisztításáról sem, ahol pektináz enzimeket használnak a pektinek lebontására, így a lé tisztább és átlátszóbb lesz. Az élelmiszeriparban használt enzimek biztonságosak és hatékonyak, szigorú szabályozás mellett alkalmazzák őket.
Enzimek a gyógyszergyártásban
Az enzimek a gyógyszergyártásban is kulcsszerepet játszanak, hiszen lehetővé teszik komplex molekulák előállítását, gyakran sokkal hatékonyabban és környezetbarátabb módon, mint a hagyományos kémiai szintézisek. Például, enzimek segítségével állíthatók elő királis molekulák, amelyek a gyógyszerek hatékonysága szempontjából kritikusak, mivel csak egyetlen izomer fejti ki a kívánt hatást.
Az enzimeket felhasználják továbbá gyógyszerhatóanyagok módosítására is, például glikozilálásra, ami javíthatja a hatóanyag oldhatóságát, stabilitását vagy célzottabbá teheti a hatását. A biotechnológiai úton előállított gyógyszerek, például az inzulin vagy a növekedési hormon, szintén enzimek közreműködésével jönnek létre.
Az enzimtechnológia alkalmazása a gyógyszergyártásban nem csupán a költséghatékonyságot növeli, hanem hozzájárul a fenntarthatóbb és zöldebb gyártási folyamatok kialakításához is.
Ezenkívül, az enzimek a gyógyszerfejlesztésben is fontosak, például a hatóanyagok metabolizmusának vizsgálatában, ami elengedhetetlen a gyógyszerek biztonságosságának és hatékonyságának megértéséhez. A gyógyszeripari enzimek piaca folyamatosan bővül, ahogy egyre több új alkalmazási lehetőséget fedeznek fel.
Új irányok az enzimkutatásban: enzimtervezés és szintézis
Az enzimkutatás napjainkban egy izgalmas transzformáción megy keresztül, ahol a természet által kínált enzimek tanulmányozása mellett a hangsúly egyre inkább az enzimek tervezésére és szintézisére helyeződik át. Ez a terület a biokémia és a biotechnológia határán mozog, és forradalmasíthatja az ipari katalízist, a gyógyszerfejlesztést és a környezetvédelmet.
A hagyományos enzimkutatás a természetben megtalálható enzimek izolálására és jellemzésére fókuszált. Az enzimtervezés azonban lehetővé teszi számunkra, hogy olyan enzimeket hozzunk létre, amelyek nincsenek jelen a természetben, vagy a meglévő enzimeket optimalizáljuk adott feladatokra. Ehhez a számítógépes modellezés, a fehérjemérnökség és a szintetikus biológia eszközeit használjuk.
A cél olyan enzimek létrehozása, amelyek hatékonyabban, szelektívebben és stabilabban katalizálják a kívánt reakciókat, mint a természetben megtalálható enzimek.
A de novo enzimtervezés során a nulláról indulva, egy adott reakciót katalizáló enzim szerkezetét tervezzük meg. Ez rendkívül komplex feladat, de a számítógépes algoritmusok fejlődésével egyre több sikeres példát láthatunk. Az enzim szintézise során pedig a megtervezett fehérjeszekvenciát kódoló gént juttatjuk be egy sejtbe, amely aztán legyártja a kívánt enzimet. Ezzel a módszerrel új anyagcsereutakat is létrehozhatunk.
Az enzimtervezés és szintézis nem csupán tudományos érdekesség, hanem konkrét alkalmazási lehetőségeket is rejt magában. Gondoljunk például a környezetszennyező anyagok lebontására tervezett enzimekre, vagy a gyógyszeriparban használt, rendkívül specifikus katalizátorokra.