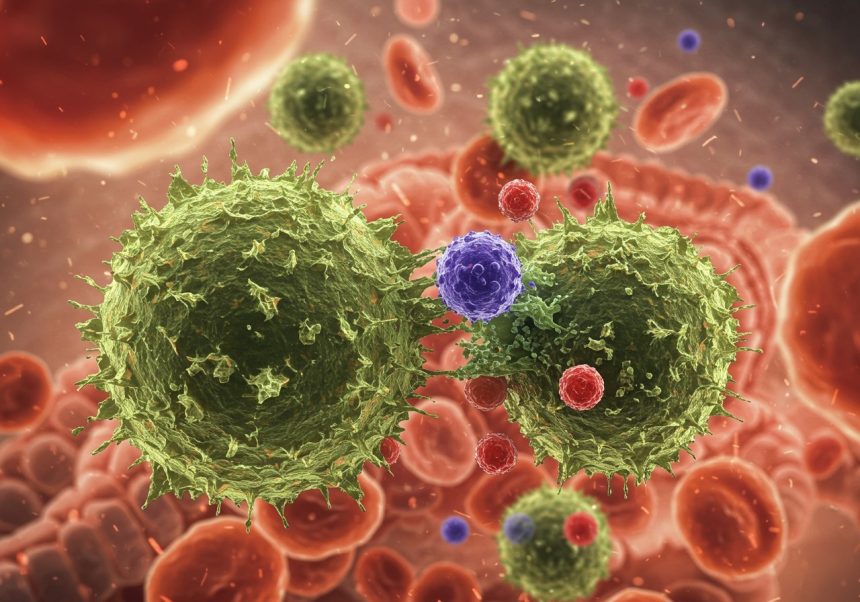
A falósejtek, avagy fagociták, az immunrendszerünk első vonalát képezik a kórokozókkal szemben. Ők azok a „névtelen hősök”, akik folyamatosan járőröznek a testünkben, felkutatva és ártalmatlanítva a veszélyt jelentő idegen anyagokat, mint például baktériumokat, vírusokat, elhalt sejteket és egyéb törmeléket. Ezt a folyamatot fagocitózisnak nevezzük, ami szó szerint „sejtevés”-t jelent.
Képzeljük el őket, mint a testünk takarítóit és katonáit egyben. Feladatuk nem csupán a kórokozók elpusztítása, hanem a sérült szövetek helyreállításának elősegítése is. Különböző típusú falósejtek léteznek, mindegyikük speciális feladatkörrel. Például a neutrofilek a leggyakoribb falósejtek a vérben, és gyorsan a fertőzés helyszínére vonulnak. A makrofágok pedig nagyobb „falók”, amelyek nemcsak a kórokozókat nyelik el, hanem az elhalt sejteket és a szöveti törmeléket is eltakarítják, ezzel elősegítve a gyógyulást.
A falósejtek tehát kulcsfontosságúak a szervezet védekezésében, hiszen közvetlenül és azonnal reagálnak a fenyegetésekre, megakadályozva a fertőzések elterjedését és a súlyosabb betegségek kialakulását.
A falósejtek munkája rendkívül összetett. Különféle receptorokkal rendelkeznek a felületükön, amelyek segítségével felismerik a kórokozókat. Miután a falósejt elnyelte az idegen anyagot, egy fagoszóma nevű vezikulum keletkezik, amely egyesül egy lizoszómával. A lizoszómában található enzimek lebontják és megsemmisítik a kórokozót. A falósejtek nem csupán „megeszik” a kórokozókat, hanem a feldolgozott antigéneket a sejtfelületükre helyezve prezentálják a többi immunsejtnek, ezzel aktiválva a specifikus immunválaszt is.
A falósejtek definíciója és típusai: makrofágok, neutrofilek, dendritikus sejtek, hízósejtek
A falósejtek, vagy fagociták, az immunrendszer kulcsfontosságú sejtjei, amelyek a szervezetbe jutott káros anyagok – például baktériumok, vírusok, elhalt sejtek és egyéb törmelék – bekebelezésével és lebontásával védik meg a testet. Ezt a folyamatot nevezzük fagocitózisnak.
Számos különböző típusú falósejt létezik, melyek mindegyike speciális szerepet tölt be az immunválaszban:
- Makrofágok: Nagy méretű, „mindent bekebelező” sejtek, amelyek a szövetekben találhatók. Feladatuk a kórokozók elpusztítása és a sejttörmelék eltakarítása. Emellett ők is bemutatják az antigéneket más immunsejteknek, elindítva ezzel a specifikus immunválaszt.
- Neutrofilek: A leggyakoribb fehérvérsejtek a vérben. Gyorsan a fertőzés helyszínére érkeznek és nagy mennyiségben pusztítják a baktériumokat. Rövid életűek, és elhalásukkal genny képződik.
- Dendritikus sejtek: Elsődleges feladatuk az antigének felvétele a szövetekben és azok elszállítása a nyirokcsomókba, ahol bemutatják őket a T-sejteknek. Ezzel elindítják az adaptív immunválaszt.
- Hízósejtek: A szövetekben, különösen a bőrben, a tüdőben és a bélrendszerben találhatók. Bár nem klasszikus fagociták, de képesek korlátozott mértékben fagocitózisra. Fő szerepük a gyulladásos válasz szabályozása hisztamin és más mediátorok felszabadításával, ami fontos a paraziták elleni védekezésben, de allergiás reakciókban is szerepet játszanak.
A falósejtek sokfélesége és eltérő működési mechanizmusai biztosítják, hogy a szervezet hatékonyan tudjon védekezni a különböző típusú fenyegetésekkel szemben.
Fontos megjegyezni, hogy a falósejtek közötti kommunikáció és együttműködés elengedhetetlen a hatékony immunválaszhoz. Például a makrofágok által termelt citokinek aktiválják a neutrofileket, míg a dendritikus sejtek a T-sejtek aktiválásával segítik a szervezet specifikus védekezésének kialakítását.
A fagocitózis folyamata: felismerés, kötődés, bekebelezés, emésztés és antigén prezentáció
A falósejtek, az immunrendszer élharcosai, a fagocitózis nevű folyamat révén védik meg a szervezetet. Ez a folyamat nem más, mint a káros anyagok, sejttörmelékek és kórokozók bekebelezése és lebontása. A fagocitózis több jól elkülöníthető lépésből áll, amelyek biztosítják a hatékony védekezést.
1. Felismerés: A falósejtek a környezetüket kémiai jelek alapján pásztázzák. Ezek a jelek lehetnek „veszélyjelzések”, mint például a baktériumok sejtfalának komponensei (pl. lipopoliszacharid, LPS) vagy a károsodott sejtek által kibocsátott molekulák. A falósejtek felszínén receptorok találhatók, amelyek ezekhez a jelekhez kötődnek. Ezek a receptorok lehetnek specifikusak (pl. antitestekhez kötődő receptorok) vagy nem-specifikusak (pl. a komplement rendszerhez kötődő receptorok).
2. Kötődés: Miután a falósejt felismerte a bekebelezendő anyagot, szoros kapcsolatot kell kialakítania vele. Ezt elősegíthetik az opsoninek, amelyek a kórokozókhoz kötődve „megjelölik” őket a falósejtek számára. Az opsoninek lehetnek antitestek vagy a komplement rendszer egyes fehérjéi. A kötődés aktiválja a falósejtet, előkészítve a bekebelezésre.
3. Bekebelezés: A kötődés hatására a falósejt membránja kitüremkedik, és körbeveszi a bekebelezendő anyagot. Ez a membránkitüremkedés pszeudopódiumoknak nevezik. A pszeudopódiumok összeolvadnak, létrehozva egy fagoszómát, egy membránnal határolt hólyagot, amely tartalmazza a bekebelezett anyagot.
4. Emésztés: A fagoszóma ezután egyesül egy lizoszómával, egy olyan sejtszervecskével, amely emésztőenzimeket tartalmaz. Az így létrejött fagolizoszóma belsejében a lizoszómális enzimek lebontják a bekebelezett anyagot. A lebontás során keletkező anyagok egy része felhasználásra kerül a falósejt számára, míg a többi kiürül a sejtből.
A fagocitózis nem csupán a kórokozók elpusztítására szolgál, hanem az immunválasz elindításában is kulcsszerepet játszik.
5. Antigén prezentáció: Bizonyos falósejtek, mint például a dendritikus sejtek és a makrofágok, az emésztés során keletkezett antigéneket a sejt felszínére juttatják. Ezt a folyamatot antigén prezentációnak nevezik. Az antigéneket a sejt felszínén speciális molekulák, az MHC (Major Histocompatibility Complex) molekulák mutatják be a T-sejteknek, elindítva az adaptív immunválaszt. Ezáltal a falósejtek összekötik a veleszületett és az adaptív immunitást, biztosítva a szervezet komplex és hatékony védekezését.
A makrofágok szerepe a szöveti homeosztázisban és a gyulladás szabályozásában
A makrofágok kulcsszerepet játszanak a szöveti homeosztázis fenntartásában és a gyulladás szabályozásában. Ezek a falósejtek nem csak a kórokozók eltávolításáért felelősek, hanem a sérült sejtek és a sejttörmelék eltakarításáért is, ami elengedhetetlen a szövetek egészséges működéséhez.
A szöveti homeosztázisban betöltött szerepük sokrétű. Egyrészt, a makrofágok folyamatosan monitorozzák a környezetüket, és érzékelik a változásokat, például a sejtkárosodást vagy a fertőzést. Másrészt, aktívan részt vesznek a szöveti újjáépítésben, például a sebgyógyulás során. Eltávolítják a károsodott mátrixot és serkentik az új szövet kialakulását.
A gyulladás szabályozásában a makrofágok kétélű kardként viselkednek. Egyrészt, a gyulladásos válasz elindításában és fenntartásában is szerepet játszanak, citokinek és kemokinek termelésével, amelyek más immunsejteket vonzanak a helyszínre. Másrészt, a gyulladás csillapításában is részt vesznek, gyulladáscsökkentő faktorok felszabadításával és a gyulladásos sejtek eltávolításával.
A makrofágok polarizációja, vagyis a különböző aktivációs állapotokba való átalakulása, kulcsfontosságú a gyulladás szabályozásában. Az M1 típusú makrofágok gyulladáskeltőek, míg az M2 típusúak gyulladáscsökkentőek és a szöveti regenerációt segítik elő.
A makrofágok működési zavarai számos betegséghez vezethetnek, mint például a krónikus gyulladásos betegségek (reumatoid artritisz, Crohn-betegség) és a daganatok. A makrofágok aktivációjának és polarizációjának pontos szabályozása ezért kiemelten fontos a szervezet egészsége szempontjából.
A neutrofilek: a veleszületett immunválasz első vonala a bakteriális fertőzések ellen
A neutrofilek a veleszületett immunválasz leggyakoribb és legfontosabb sejtjei, különösen a bakteriális fertőzések elleni védekezésben. Ők az elsők, akik a fertőzés helyszínére érkeznek, és kulcsszerepet játszanak a kórokozók eliminálásában.
A neutrofilek a csontvelőben termelődnek, és a véráramba kerülnek. Ha egy bakteriális fertőzés alakul ki, a fertőzött szövetek gyulladásos jeleket bocsátanak ki (kemokineket), amelyek odavonzzák a neutrofileket. Ezt a folyamatot kemotaxisnak nevezzük.
A neutrofilek többféle módon pusztítják el a baktériumokat:
- Fagocitózis: A neutrofilek bekebelezik a baktériumokat, majd lizoszómákkal (sejten belüli emésztő egységekkel) megsemmisítik azokat.
- DeGranuláció: A neutrofilek granulumokat (szemcséket) tartalmaznak, amelyek antimikrobiális anyagokat, például enzimeket és toxikus fehérjéket tartalmaznak. Ezeket a granulumokat a baktériumok közelébe ürítik, hogy elpusztítsák azokat.
- NETózis (Neutrophil Extracellular Traps): A neutrofilek képesek egyfajta „csapdát” képezni a baktériumoknak. A sejt DNS-ét és a granulumokból származó antimikrobiális anyagokat a sejten kívülre dobják, ezzel egy hálót képezve, amely megfogja és elpusztítja a baktériumokat.
A neutrofilek gyors reakcióidejük és hatékony pusztító mechanizmusaik miatt nélkülözhetetlenek a bakteriális fertőzések korai szakaszában.
Bár a neutrofilek rendkívül hatékonyak a kórokozók elleni harcban, túlzott aktivitásuk káros is lehet. A neutrofilek által okozott gyulladás hozzájárulhat a szövetkárosodáshoz és a krónikus gyulladásos betegségek kialakulásához.
A neutrofilek száma a vérben fontos diagnosztikai információt nyújt. A magas neutrofilszám (neutrophilia) gyakran bakteriális fertőzésre utal, míg az alacsony neutrofilszám (neutropenia) növelheti a fertőzésekkel szembeni fogékonyságot.
A dendritikus sejtek mint a veleszületett és szerzett immunválasz közötti híd
A dendritikus sejtek (DC) kulcsszerepet játszanak a veleszületett és a szerzett immunválasz közötti összeköttetésben. Míg a többi falósejt, mint például a makrofágok, elsősorban a kórokozók elpusztítására koncentrálnak, a DC-k feladata ennél összetettebb. Ők a szervezet szenzorai, folyamatosan monitorozzák a szöveteket idegen anyagok, azaz antigének után kutatva.
Amikor egy DC találkozik egy antigénnel (például egy baktériummal vagy vírussal), bekebelezi azt endocitózis vagy fagocitózis útján. Ezt követően az antigént feldolgozza, azaz kisebb peptidekre bontja. A legfontosabb lépés ezután következik: a DC a peptideket a sejtfelszínén található MHC (Major Histocompatibility Complex) molekulákon keresztül prezentálja. Ez a prezentáció elengedhetetlen a szerzett immunválasz aktiválásához.
A dendritikus sejtek tehát nem csupán elpusztítják a kórokozókat, hanem bemutatják azokat a T-sejteknek, elindítva ezzel a specifikus immunválaszt.
A DC-k a nyirokcsomókba vándorolnak, ahol találkoznak a naiv T-sejtekkel. A DC és a T-sejt közötti interakció során a T-sejt aktiválódik, és elkezd szaporodni, létrehozva egy specifikus immunválaszt az adott antigén ellen. A DC-k által kibocsátott citokinek befolyásolják, hogy milyen típusú T-sejt válasz alakul ki (pl. citotoxikus T-sejt vagy helper T-sejt). Ez a válasz finomhangolása kritikus a hatékony védekezéshez.
Fontos megjegyezni, hogy a DC-k nem csak a kórokozók ellen indítanak immunválaszt. Toleranciát is kialakíthatnak a saját antigénekkel szemben, megakadályozva az autoimmun betegségek kialakulását. Ez a tolerogén funkciójuk is rendkívül fontos az immunrendszer egyensúlyának fenntartásában.
A hízósejtek és a szerepük az allergiás reakciókban és a sebgyógyulásban
A hízósejtek, bár nem falósejtek, az immunrendszer fontos szereplői, különösen az allergiás reakciókban és a sebgyógyulásban. Ezek a sejtek a szövetekben találhatók, leginkább a bőrben, a légutakban és a bélrendszerben.
Az allergiás reakciók során a hízósejtek kulcsszerepet játszanak. Ha egy allergén (például pollen vagy étel) bejut a szervezetbe, az arra érzékeny egyénekben az IgE antitestek kötődnek a hízósejtek felszínéhez. Amikor az allergén ismételten találkozik ezekkel az antitestekkel, a hízósejt degranulálódik, vagyis kibocsátja a benne tárolt anyagokat, mint például a hisztamint.
A hisztamin felelős az allergiás reakciók jellegzetes tüneteiért, mint a viszketés, duzzanat, orrfolyás és nehézlégzés.
A hízósejtek azonban nem csak az allergiás reakciókban játszanak szerepet. Fontosak a sebgyógyulásban is. Amikor sérülés éri a szöveteket, a hízósejtek gyulladáskeltő anyagokat szabadítanak fel, amelyek elősegítik a vérerek tágulását és a fehérvérsejtek odavonzását a sérülés helyére. Ez a folyamat elengedhetetlen a seb tisztításához és a szövetek regenerálódásához. Ezen felül a hízósejtek által termelt növekedési faktorok segítik a kollagén termelést és a szövetek újjáépítését.
Bár a hízósejtek fontosak a védekezésben és a javításban, túlzott aktivációjuk krónikus gyulladáshoz és különböző betegségekhez vezethet.
A falósejtek receptorai: PRR-ek (Pattern Recognition Receptors) és az idegen anyagok felismerése
A falósejtek, az immunrendszer nélkülözhetetlen elemei, nem véletlenszerűen pusztítják el a betolakodókat. Képzeljük el őket, mint a szervezet őreit, akiknek speciális eszközeik vannak az ellenség azonosítására. Ezek az eszközök a sejtfelszínen, vagy éppen a sejt belsejében található PRR-ek (Pattern Recognition Receptors), azaz mintázatfelismerő receptorok.
A PRR-ek nem egy konkrét baktériumot vagy vírust ismernek fel, hanem olyan általános molekuláris mintázatokat, amelyek a kórokozókra jellemzőek, de az emberi sejtekben nincsenek jelen. Ezeket a mintázatokat PAMP-oknak (Pathogen-Associated Molecular Patterns), azaz kórokozó-asszociált molekuláris mintázatoknak nevezzük. PAMP lehet például a baktériumok sejtfalában található lipopoliszacharid (LPS) vagy a vírusok kétszálú RNS-e.
A PRR-ek sokfélesége biztosítja, hogy a falósejtek a kórokozók széles skáláját képesek felismerni. Néhány fontosabb PRR család:
- Toll-like receptorok (TLR-ek): A sejtmembránon és a sejten belüli membránokon is megtalálhatók, és különböző PAMP-okat ismernek fel, például bakteriális lipoproteineket, vírusos nukleinsavakat.
- NOD-like receptorok (NLR-ek): A citoplazmában találhatók, és a sejtbe jutott baktériumok vagy a sejt által termelt stressz-molekulák által kiváltott károsodást érzékelik.
- RIG-I-like receptorok (RLR-ek): Szintén a citoplazmában találhatóak, és vírusos RNS-t ismernek fel.
Amikor egy PRR egy PAMP-hoz kötődik, az aktiválja a falósejtet. Ez aktiválást követően a falósejt megkezdi a kórokozó bekebelezését (fagocitózis), majd megsemmisíti azt. Az aktiváció emellett gyulladásos citokinek termeléséhez is vezet, amelyek segítik az immunválasz koordinálását.
A PRR-ek és a PAMP-ok közötti kölcsönhatás tehát a falósejtek számára a belépőjegy a kórokozók elleni harcba. Ez a felismerés alapvető fontosságú az immunrendszer hatékony működéséhez.
A falósejtek PRR-jei nem csupán a kórokozók felismerésére szolgálnak. Segítségükkel a sérült vagy elhaló sejtekből származó molekulákat (DAMP-ok, Damage-Associated Molecular Patterns) is képesek azonosítani. Ezáltal a falósejtek a szöveti károsodás eltakarításában és a gyulladásos válasz szabályozásában is részt vesznek.
A TLR-ek (Toll-like receptors) szerepe a patogének felismerésében és az immunválasz aktiválásában
A falósejtek nem csupán bekebelezik a kórokozókat, hanem kulcsfontosságú szerepet játszanak az immunválasz elindításában is. Ebben kiemelkedő jelentősége van a TLR-eknek (Toll-like receptors), melyek a falósejtek felszínén és a sejten belül elhelyezkedő receptorok. Ezek a receptorok képesek felismerni a patogénekre jellemző molekuláris mintázatokat, az úgynevezett PAMP-okat (Pathogen-Associated Molecular Patterns).
A PAMP-ok lehetnek például bakteriális lipopoliszacharidok (LPS), peptidoglikánok, vírusos RNS vagy DNS. Amikor egy TLR felismer egy PAMP-ot, az aktiválja a falósejtben egy jelátviteli útvonalat. Ez a folyamat elvezet a gyulladásos citokinek, például a TNF-α, IL-1β és IL-6 termeléséhez.
A TLR-ek általi PAMP felismerés az egyik legfontosabb esemény a veleszületett immunrendszer aktiválásában, mely elindítja az adaptív immunválaszt is.
A citokinek nemcsak a gyulladást fokozzák, hanem a dendritikus sejtek érését és migrációját is elősegítik a nyirokcsomókba. A dendritikus sejtek azután bemutatják a kórokozókból származó antigéneket a T-sejteknek, ezzel aktiválva az adaptív immunrendszert. Különböző TLR-ek különböző PAMP-okat ismernek fel, ami lehetővé teszi az immunrendszer számára, hogy széles körű patogénekre reagáljon. Például, a TLR4 az LPS-t ismeri fel, míg a TLR3 a kettős szálú RNS-t.
Fontos megjegyezni, hogy a TLR-ek nem csak a falósejteken találhatók meg, hanem más immunsejteken és nem-immunsejteken is, ami azt jelenti, hogy széles körű szerepet játszanak a szervezet védekezésében. A TLR-ek működési zavarai autoimmun betegségekhez és krónikus gyulladásokhoz vezethetnek, ezért a TLR-ek működésének megértése elengedhetetlen a hatékony immunológiai terápiák kifejlesztéséhez.
A falósejtek és a citokin termelés: a gyulladásos kaszkád szabályozása
A falósejtek nem csupán bekebelezik és megsemmisítik a kórokozókat, hanem kulcsszerepet játszanak az immunválasz szabályozásában is, elsősorban a citokinek termelésén keresztül. A citokinek apró fehérjék, amelyek a sejtek közötti kommunikációt szolgálják, és elengedhetetlenek a gyulladásos kaszkád elindításához és szabályozásához. A falósejtek, miután felismerték és bekebelezték a betolakodót, aktiválódnak, és különböző citokineket kezdenek termelni.
Ezek a citokinek hatással vannak a környező sejtekre, például a többi immunsejtre, az endotélsejtekre (a vérerek belső falát borító sejtekre) és a szöveti sejtekre. A termelt citokinek típusa és mennyisége függ a felismert kórokozótól és a falósejt típusától. Például, a pro-inflammatorikus citokinek, mint az IL-1, IL-6 és TNF-alfa, elősegítik a gyulladást, a vérerek áteresztő képességének növelésével, a fehérvérsejtek toborzásával a fertőzés helyszínére, és a láz kialakulásával.
Azonban a falósejtek nem csak pro-inflammatorikus, hanem anti-inflammatorikus citokineket is termelnek, mint például az IL-10 és a TGF-β, amelyek a gyulladás csillapításában és a szöveti károsodás minimalizálásában játszanak szerepet. Ez a kettős szerep lehetővé teszi a falósejtek számára, hogy finomhangolják az immunválaszt, biztosítva, hogy az hatékony legyen a kórokozó leküzdésében, de ne okozzon túlzott károsodást a szervezetben.
A falósejtek citokin termelése szorosan szabályozott, és számos tényező befolyásolja, beleértve a kórokozó típusa mellett a környezeti jelzéseket és a genetikai hajlamot is. A citokin termelés zavarai autoimmun betegségekhez és krónikus gyulladásos állapotokhoz vezethetnek. Ezért a falósejtek citokin termelésének megértése kulcsfontosságú az immunrendszer működésének megértéséhez és a különböző betegségek kezeléséhez.
A falósejtek szerepe a tumor immunitásban: tumorsejt elpusztítás és antigén prezentáció
A falósejtek, vagy más néven fagociták, kulcsszerepet játszanak a tumor immunitásban, azaz a szervezet daganatok elleni védekezésében. Két fő mechanizmus révén járulnak hozzá ehhez: a tumorsejtek közvetlen elpusztítása és az antigén prezentáció.
A tumorsejtek elpusztítása során a falósejtek, például a makrofágok, képesek bekebelezni (fagocitózis) a daganatos sejteket. Ezt a folyamatot számos tényező befolyásolhatja, többek között a tumorsejtek által kibocsátott jelek, illetve a környező immunsejtek által termelt citokinek. A bekebelezett tumorsejt lebontásra kerül a falósejten belül, ezáltal megakadályozva a további terjedést.
Az antigén prezentáció egy másik kritikus lépés a tumor immunitásban. Miután a falósejt bekebelezett egy tumorsejtet, a sejten belüli lebontás során keletkező tumor antigének (a tumorsejtre jellemző fehérjetöredékek) a sejt felszínére kerülnek, MHC (Major Histocompatibility Complex) molekulákhoz kötve. Ezt a folyamatot nevezzük antigén prezentációnak.
Ezzel a módszerrel a falósejtek bemutatják a tumorantigéneket a T-limfocitáknak, aktiválva azokat, és elindítva egy célzott immunválaszt a daganat ellen.
Aktivált T-limfociták aztán képesek elpusztítani a tumorsejteket, illetve további immunsejteket aktiválni, erősítve a daganat elleni védekezést. Fontos megjegyezni, hogy a tumorsejtek gyakran képesek elkerülni a falósejtek általi felismerést és bekebelezést, vagy akár gátolni is tudják a falósejtek működését. A tumor immunterápia célja többek között, hogy ezt a gátlást feloldja, és megerősítse a falósejtek szerepét a daganat elleni harcban. A falósejtek aktivitásának befolyásolása ígéretes lehetőség a hatékonyabb tumor immunterápiák kifejlesztéséhez.
A falósejtek diszfunkciója és az immunhiányos állapotok
A falósejtek működési zavarai súlyos következményekkel járhatnak az immunrendszer hatékonyságára nézve. Ha a falósejtek nem képesek megfelelően elvégezni a feladataikat – például nem ismerik fel a kórokozókat, nem képesek azokat bekebelezni, vagy nem tudják elpusztítani –, az immunhiányos állapotokhoz vezethet. Ezek az állapotok fogékonyabbá teszik a szervezetet a fertőzésekre, beleértve a bakteriális, vírusos és gombás fertőzéseket is.
Számos tényező befolyásolhatja a falósejtek működését. Genetikai rendellenességek, mint például a krónikus granulomatózus betegség (CGD), közvetlenül érintik a falósejtek azon képességét, hogy reaktív oxigén gyököket termeljenek, ami elengedhetetlen a bekebelezett kórokozók elpusztításához. Más betegségek, mint például a leukémia, vagy a csontvelő transzplantáció, csökkenthetik a falósejtek számát, gyengítve ezzel az immunrendszer védekező képességét.
Bizonyos gyógyszerek, például a kemoterápiás szerek, szintén károsíthatják a falósejteket. Az autoimmun betegségek, ahol az immunrendszer a saját sejtjeit támadja meg, szintén befolyásolhatják a falósejtek működését. A helytelen táplálkozás, különösen a vitamin- és ásványianyag-hiány, szintén gyengítheti a falósejtek aktivitását.
A falósejtek diszfunkciója nem csupán a fertőzésekkel szembeni fogékonyságot növeli, hanem hozzájárulhat az autoimmun betegségek és a gyulladásos állapotok kialakulásához is.
A falósejtek diszfunkciójának diagnosztizálása speciális laboratóriumi vizsgálatokat igényel, amelyek felmérik a falósejtek számát, mozgékonyságát, bekebelező képességét és a kórokozók elpusztításának hatékonyságát. A kezelés a diszfunkció kiváltó okától függ. Antibiotikumok, gombaellenes szerek vagy vírusellenes gyógyszerek alkalmazhatók a fertőzések leküzdésére. Bizonyos esetekben immunglobulin terápiára vagy csontvelő transzplantációra is szükség lehet az immunrendszer helyreállításához.