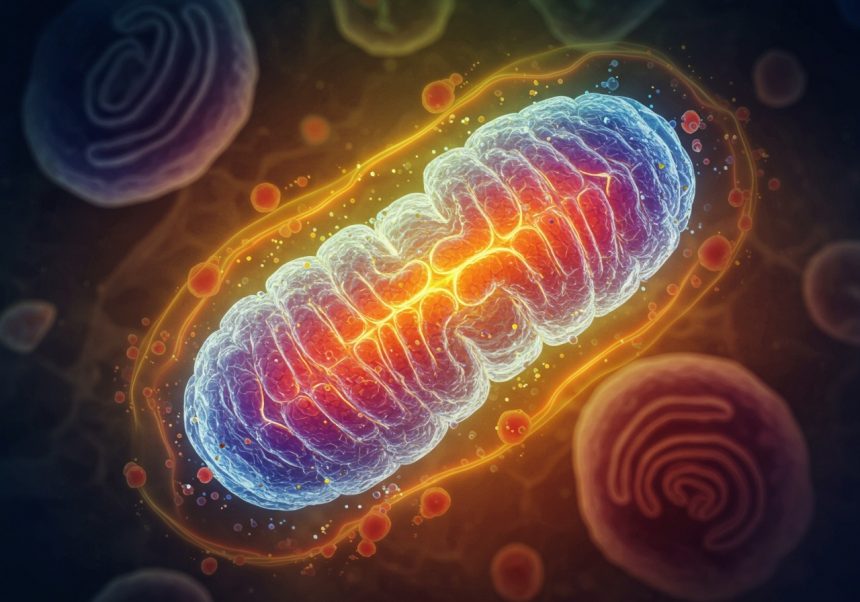
Sejtjeink energiaellátásának kulcsszereplői a mitokondriumok, melyek a sejtekben található apró, de annál fontosabb sejtszervecskék. Ezek a parányi „erőművek” felelősek a sejt számára szükséges energia, az ATP (adenozin-trifoszfát) előállításáért. A mitokondriumok nélkül a sejtek nem lennének képesek elvégezni alapvető funkcióikat, mint például az izomösszehúzódás, az idegimpulzusok továbbítása, vagy a fehérjék szintézise.
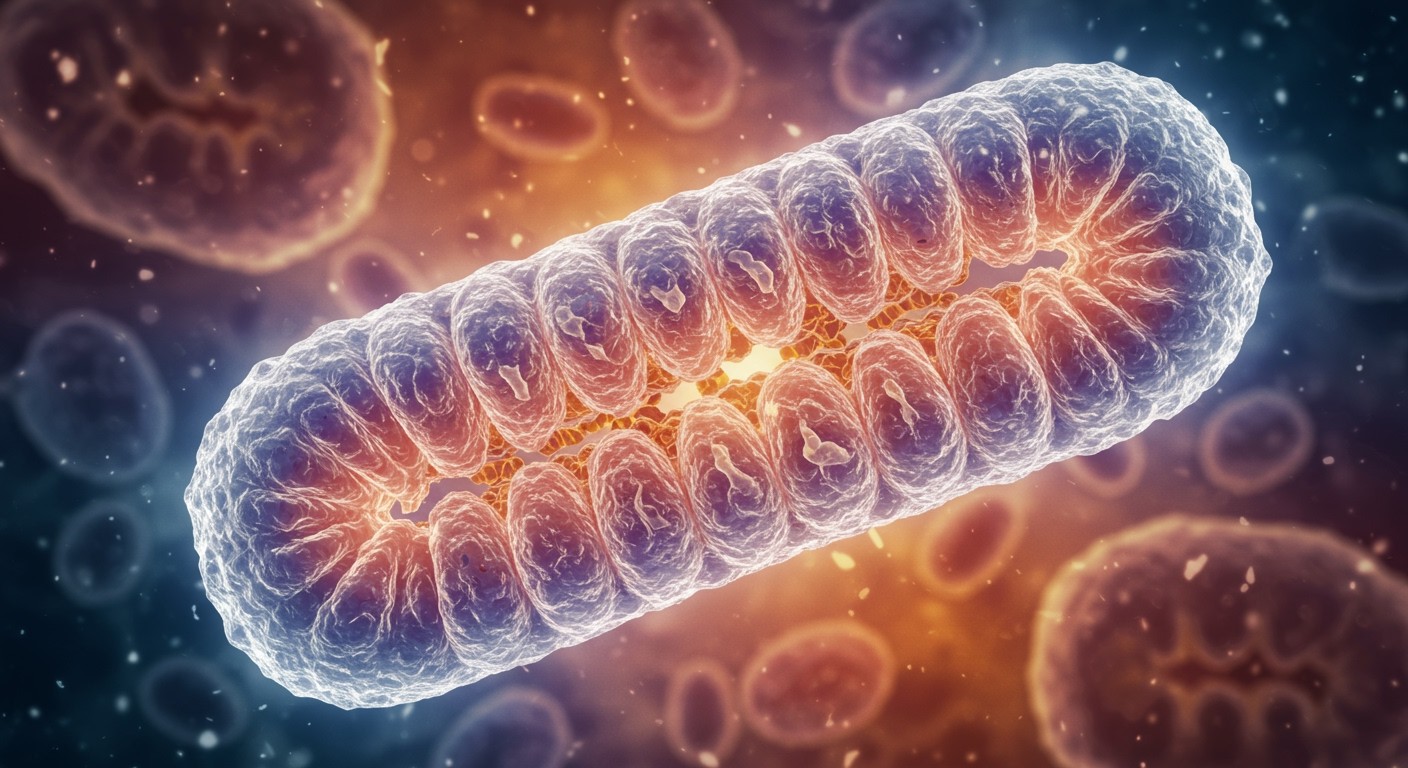
A mitokondriumok különleges felépítéssel rendelkeznek: kettős membrán veszi őket körül. A belső membrán erősen felgyűrődött, ezeket a redőket cristae-nek nevezzük. A cristae-k növelik a felületet, ami létfontosságú az ATP-termeléshez. A belső membrán és a külső membrán között található a mitokondriális mátrix, mely számos enzimet és a mitokondriális DNS-t tartalmazza.
A mitokondriumok tehát a sejtek energiaszolgáltatói, az ATP előállításának központjai, melyek nélkülözhetetlenek a sejt életben maradásához és működéséhez.
Érdekesség, hogy a mitokondriumoknak saját DNS-ük van, ami arra utal, hogy evolúciós szempontból eredetileg önálló baktériumok voltak, melyek szimbiózisba léptek az eukarióta sejtekkel. Ez a szimbiózis tette lehetővé a komplex sejtek kialakulását és a magasabb rendű életformák megjelenését. A mitokondriális DNS-t az anyától örököljük, ezért a mitokondriális betegségek öröklődése is speciális mintázatot mutat.
A mitokondriumok száma a sejtekben változó, függően a sejt energiaigényétől. Például az izomsejtekben sokkal több mitokondrium található, mint a bőrsejtekben. A mitokondriumok nem csupán energia termelésére szolgálnak, hanem részt vesznek a kalcium-szabályozásban, a sejthalál (apoptózis) szabályozásában és más fontos sejtfolyamatokban is.
A mitokondriumok eredete és evolúciója: az endoszimbiotikus elmélet
A mitokondriumok, sejtjeink energiaellátásának központi szereplői, meglepő eredettel rendelkeznek. A jelenlegi tudományos konszenzus szerint a mitokondriumok endoszimbiózis útján kerültek a sejtjeinkbe. Ez az elmélet azt feltételezi, hogy egykor szabadon élő baktériumok voltak, amelyek bekebeleződtek egy ősi eukarióta sejtbe.
Ez a bekebelezés nem pusztulást, hanem szimbiózist eredményezett. A baktérium, amely a mitokondrium ősének tekinthető, védett környezetet kapott a nagyobb sejtben, cserébe pedig energia előállításával járult hozzá a sejt működéséhez. Ez az energia, elsősorban ATP formájában, kulcsfontosságú a sejt életfunkcióihoz.
A legfontosabb bizonyíték az endoszimbiotikus elmélet alátámasztására az, hogy a mitokondriumok saját DNS-sel rendelkeznek, amely kör alakú, és a baktériumok DNS-ére emlékeztet. Ezenkívül a mitokondriumok képesek önállóan osztódni, ami szintén a baktériumokra jellemző.
További bizonyítékok közé tartozik a mitokondriális riboszómák szerkezete, amelyek inkább a baktériumok riboszómáira hasonlítanak, mint az eukarióta sejtek riboszómáira. A kettős membrán is az endoszimbiózis nyoma: a belső membrán az ősi baktérium membránja, a külső membrán pedig az azt bekebelező eukarióta sejt membránjából származik.
Az endoszimbiotikus elmélet megértése elengedhetetlen a mitokondriumok működésének és szerepének teljes körű megértéséhez. Az, hogy a sejtjeink energiaellátását biztosító organellum valójában egykor önálló életet élő baktérium volt, rávilágít az evolúció kreativitására és a szimbiózis fontosságára az élet fejlődésében.
A mitokondriumok szerkezete: külső és belső membrán, mátrix, kristák
A mitokondriumok, a sejtek erőművei, bonyolult szerkezettel rendelkeznek, amely elengedhetetlen a hatékony energiatermeléshez. Ez a szerkezet négy fő részből áll: a külső membránból, a belső membránból, a mátrixból és a kristákból.
A külső membrán sima, és körülveszi az egész mitokondriumot. Ez a membrán viszonylag áteresztő, mivel számos porint tartalmaz, amelyek lehetővé teszik a kis molekulák és ionok szabad áramlását a mitokondrium és a citoszól között. Ez a permeabilitás fontos a mitokondrium anyagcseretermékeinek cseréjéhez.
A belső membrán sokkal összetettebb. Ez a membrán erősen felgyűrődött, és ezek a gyűrődések alkotják a kristákat. A kristák növelik a belső membrán felületét, ami kulcsfontosságú a sejtlégzéshez. A belső membrán nem áteresztő a legtöbb ion és molekula számára, csak speciális transzporterek segítségével juthatnak át rajta anyagok. Itt találhatóak az elektrontranszportlánc fehérjekomplexei és az ATP-szintáz, amelyek az ATP (adenozin-trifoszfát), a sejt „energiavalutájának” előállításában játszanak szerepet.
A belső membrán által határolt tér a mátrix. Ez a mitokondrium „belseje”, ahol a citromsavciklus (vagy Krebs-ciklus) enzimei találhatók. A citromsavciklus során a szerves molekulák lebontása történik, és nagy energiájú elektronhordozók (NADH és FADH2) keletkeznek. A mátrix továbbá tartalmazza a mitokondriális DNS-t, riboszómákat és egyéb enzimeket, amelyek a mitokondriális fehérjék szintéziséhez szükségesek.
A kristák kialakítása maximalizálja a belső membrán felületét, ezáltal optimalizálja az ATP szintézisének helyét, ami elengedhetetlen a sejtek energiaellátásához.
A mitokondriumok szerkezete tehát szorosan összefügg a funkciójukkal. A külső membrán védelmet nyújt, a belső membrán és a kristák biztosítják az energiatermelés helyét, a mátrix pedig a biokémiai reakciók színtere.
A mitokondriális DNS (mtDNS): genetikai kód és öröklődés
A mitokondriumok saját genetikai anyaggal rendelkeznek, a mitokondriális DNS-sel (mtDNS). Ez a DNS kör alakú, és a sejtmagban található DNS-től eltérően, kevesebb gént tartalmaz. Ezek a gének főként a mitokondriális légzési lánc fehérjéinek, valamint a transzfer RNS-eknek (tRNS) és riboszomális RNS-eknek (rRNS) kódolására szolgálnak – ezek elengedhetetlenek a mitokondriális fehérjeszintézishez.
Az mtDNS öröklődése speciális: szinte kizárólag anyai ágon öröklődik. Ez azt jelenti, hogy az utódok az anyjuk mitokondriumaiból származó mtDNS-t kapják, mivel a spermiumok általában nem juttatnak mitokondriumokat a megtermékenyített petesejtbe. Ez az egyedi öröklési mód fontos szerepet játszik bizonyos genetikai betegségek terjedésében.
Az mtDNS mutációi viszonylag gyakoriak, mivel a mitokondriumok belsejében intenzív oxidatív stressz uralkodik, ami károsíthatja a DNS-t. Ezenkívül az mtDNS-nek nincs olyan hatékony javító mechanizmusa, mint a sejtmagi DNS-nek. A felhalmozódó mutációk mitokondriális diszfunkcióhoz vezethetnek, és számos betegségben játszhatnak szerepet, beleértve az idegrendszeri betegségeket, a szívbetegségeket és a cukorbetegséget.
Az anyai öröklődés azt jelenti, hogy a mitokondriális betegségekben szenvedő anyák minden gyermekükre átadhatják a hibás mtDNS-t, bár a betegség súlyossága változó lehet a mutáció mértékétől és a sejtekben található egészséges és hibás mtDNS arányától függően (heteroplazmia).
A mitokondriális DNS tanulmányozása kulcsfontosságú a mitokondriális betegségek megértéséhez és kezeléséhez, valamint az öregedés és más komplex betegségek kutatásához.
A légzési lánc (elektrontranszportlánc) működése: komplexek I-IV
A mitokondriumok belső membránjában található légzési lánc (elektrontranszportlánc) az a folyamat, amely a NADH és FADH2 által szállított elektronok energiáját felhasználva protonokat pumpál a mátrixból a membránok közti térbe, létrehozva ezzel egy elektrokémiai gradienset. Ez a gradiens hajtja majd az ATP-szintázt, ami az ATP előállításához szükséges.
A légzési lánc négy nagy komplexből (I-IV) áll, melyek mindegyike specifikus redox reakciókat katalizál. Az I. komplex (NADH-koenzim Q reduktáz) fogadja a NADH-tól származó elektronokat, és átadja azokat a koenzim Q-nak (ubikinon), miközben négy protont pumpál a mátrixból a membránok közti térbe. Ez a komplex tartalmazza az FMN-t (flavin-mononukleotid) és vas-kén klasztereket.
A II. komplex (szukcinát-koenzim Q reduktáz) a citrátkör egyik enzimje, a szukcinát-dehidrogenáz. Katalizálja a szukcinát fumaráttá alakulását, mely során FADH2 keletkezik, és az elektronokat közvetlenül a koenzim Q-nak adja át. Fontos megjegyezni, hogy a II. komplex nem pumpál protonokat a membránok közti térbe.
A III. komplex (koenzim Q-citokróm c reduktáz) a koenzim Q-tól fogadja az elektronokat, és átadja azokat a citokróm c-nek. Ez a komplex is pumpál protonokat a membránok közti térbe, növelve ezzel a protongradienst. A III. komplex tartalmaz citokróm b-t és citokróm c1-et, valamint vas-kén klasztereket.
A IV. komplex (citokróm c-oxidáz) a citokróm c-től fogadja az elektronokat, és végül az oxigénre adja át, mely vízzé redukálódik. Ez a folyamat is protonpumpálással járul hozzá a protongradienshez. A IV. komplex tartalmaz citokróm a-t és citokróm a3-at, valamint réz ionokat. Az oxigén itt játszik kulcsszerepet, mint végső elektronakceptor.
A légzési lánc komplexei (I-IV) szekvenciálisan adják át egymásnak az elektronokat, miközben a felszabaduló energia egy részét a protongradiens létrehozására használják fel, ami az ATP-szintézis alapja.
A légzési lánc működését számos tényező befolyásolhatja, például a redoxpotenciálok különbsége a különböző komplexek között, a rendelkezésre álló elektronhordozók mennyisége (NADH, FADH2), valamint a komplexek szerkezeti integritása. Hibás működés esetén a sejtek energiaellátása károsodhat, ami súlyos betegségekhez vezethet.
Az oxidatív foszforiláció (OXPHOS): ATP szintézis és a proton gradiens
Az oxidatív foszforiláció (OXPHOS) a mitokondrium belső membránjában zajló folyamat, melynek során a szervezetünk által felhasznált energia, az ATP (adenozin-trifoszfát) nagy része keletkezik. Ez a folyamat a citrátkörből és a glikolízisből származó elektronhordozók (NADH és FADH2) által szállított elektronok felhasználásával valósul meg.
Az elektronok az elektron transzportláncon (ETC) keresztül áramlanak, mely négy fehérjekomplexből (I-IV. komplex) áll. Az elektronok áramlása során a komplexek protonokat (H+) pumpálnak a mitokondrium mátrixából a membránok közötti térbe. Ez a protonpumpálás elektrokémiai gradienset hoz létre – magas protonkoncentráció a membránok között, alacsony a mátrixban. Ez a gradiens tárolt potenciális energiát jelent.
A létrejött proton gradiens hajtja az ATP szintáz működését, ami egy membránba ágyazott enzimkomplex. A protonok az ATP szintázon keresztül áramlanak vissza a mátrixba, a gradiens által generált energia felhasználásával. Ez az energia ADP-ből (adenozin-difoszfát) és foszfátból ATP-t szintetizál.
Az OXPHOS hatékonysága kulcsfontosságú a sejt energiaellátásához. A folyamat hatékonyságát befolyásolhatják különböző tényezők, például a mitokondriális membrán integritása, az elektron transzportlánc komplexek működése és a proton gradiens fenntartása. A mitokondriális diszfunkció, beleértve az OXPHOS zavarait, számos betegséghez vezethet, például idegrendszeri problémákhoz és izombetegségekhez.
Fontos megjegyezni, hogy az OXPHOS nem csak ATP-t termel, hanem hőt is. Ez a hőtermelés különösen fontos a hideg környezetben élő állatok számára, ahol a termogenezis (hőtermelés) segít fenntartani a testhőmérsékletet.
A citromsavciklus (Krebs-ciklus): a központi metabolikus útvonal
A citromsavciklus, más néven Krebs-ciklus vagy trikarbonsavciklus (TCA-ciklus), a mitokondriumokban zajló központi metabolikus útvonal, amely kulcsszerepet játszik a sejtjeink energiaellátásában. Ez egy ciklikus folyamat, ami azt jelenti, hogy a reakciók során felhasznált molekulák végül regenerálódnak, lehetővé téve a ciklus folyamatos működését.
A ciklus lényege, hogy az acetil-CoA (az aminosavak, zsírsavak és szénhidrátok lebontásának végterméke) belép a ciklusba, ahol fokozatos oxidáción megy keresztül. Ennek során szén-dioxid (CO2) szabadul fel, és nagy energiájú elektronhordozók (NADH és FADH2) keletkeznek.
A citromsavciklus nem közvetlenül termel nagy mennyiségű ATP-t (a sejt fő energiahordozója), de létfontosságú a NADH és FADH2 előállításához. Ezek az elektronhordozók aztán az elektrontranszportláncba kerülnek, ahol az oxidatív foszforiláció során ATP keletkezik. Így a citromsavciklus közvetetten, de jelentősen hozzájárul a sejt energiaellátásához.
A ciklus fontos intermedierjei nem csak az energiatermelésben játszanak szerepet, hanem számos más metabolikus útvonal kiindulópontjai is. Például, a citrát részt vehet a zsírsavszintézisben, az α-ketoglutarát pedig az aminosavak szintézisében.
A citromsavciklus tehát nem csupán egy energiatermelő folyamat, hanem egy központi anyagcsere-csomópont, amely összeköti a szénhidrát-, zsír- és fehérjeanyagcserét, és kulcsfontosságú a sejt homeosztázisának fenntartásában.
A citromsavciklus szabályozása komplex és szigorú. A ciklus sebességét befolyásolják az ATP, NADH és citrát koncentrációk, valamint a kalciumionok jelenléte. Mindez biztosítja, hogy a sejt energiaellátása a pillanatnyi igényekhez igazodjon.
A béta-oxidáció: zsírsavak lebontása és energia termelése
A mitokondriumok kulcsszerepet játszanak a zsírsavak lebontásában, ez a folyamat a béta-oxidáció. Ez a metabolikus út a zsírsavak lebontásának elsődleges módja, és jelentős mennyiségű energiát termel a sejtek számára. A folyamat a mitokondrium mátrixában zajlik.
A béta-oxidáció során a hosszú szénláncú zsírsavak fokozatosan rövidülnek le két szénatomos egységekkel, amelyek acetil-CoA molekulákká alakulnak. Minden egyes ciklus során négy reakció játszódik le, melyek során FADH2 és NADH molekulák is keletkeznek. Ezek a molekulák később az elektrontranszportláncban (légzési lánc) kerülnek felhasználásra, ahol ATP, vagyis a sejtek fő energiavalutája termelődik.
A béta-oxidáció rendkívül hatékony energiaforrás. Egyetlen zsírsav molekula lebontása sokkal több ATP-t eredményez, mint egy glükóz molekula lebontása.
A béta-oxidáció szabályozása szorosan összefügg a szervezet energiaigényével. Ha a sejteknek sok energiára van szükségük, a béta-oxidáció felgyorsul. Ezt különböző enzimek aktivitásának szabályozásával érik el. Például a karnitin-palmitoiltranszferáz I (CPT-I) enzim szabályozza a zsírsavak bejutását a mitokondriumokba, és ezáltal a béta-oxidációt is.
A béta-oxidáció nem csak energia termelésére szolgál. Az acetil-CoA molekulák, amelyek a béta-oxidáció során keletkeznek, a citromsavciklusba is beléphetnek, ahol tovább oxidálódnak, és még több energiát termelnek. Emellett az acetil-CoA a ketontestek szintéziséhez is felhasználható, ami alternatív energiaforrásként szolgálhat az agy és más szövetek számára, különösen éhezés vagy alacsony szénhidrátbevitel esetén.
A mitokondriális dinamika: fúzió és fisszió
A mitokondriumok nem statikus, elszigetelt organellumok. Folyamatosan változnak, dinamikus hálózatot alkotva, melynek alapja a fúzió (összeolvadás) és a fisszió (szétválás). Ez a dinamika kulcsfontosságú a sejtek egészséges energiaellátásának biztosításában.
A fúzió lehetővé teszi a mitokondriumok számára, hogy megosszák egymással a tartalmukat, így kompenzálva a károsodott molekulákat és biztosítva a mitokondriális DNS (mtDNS) egyenletes eloszlását. Ez különösen fontos a légzési lánc optimális működéséhez, hiszen a légzési lánc fehérjéit mind a sejtmag, mind a mitokondriumok kódolják. A fúzió során az egészséges mitokondriumok „feljavíthatják” a kevésbé hatékonyakat.
Ezzel szemben a fisszió lehetővé teszi a sérült mitokondriumok elkülönítését és eltávolítását mitofágia útján, ami egy szelektív autofágia típus. A fisszió emellett elengedhetetlen a mitokondriumok eloszlásához a sejtben, különösen a magas energiaigényű területeken.
A mitokondriális dinamika egyensúlya – a fúzió és a fisszió aránya – kritikus fontosságú a sejt energiaellátásának optimalizálásához és a mitokondriális minőség-ellenőrzéshez.
Ennek a dinamikus egyensúlynak a felborulása számos betegséghez vezethet, beleértve a neurodegeneratív betegségeket, a szív- és érrendszeri betegségeket és a rákot. A mitokondriális dinamikát szabályozó molekuláris mechanizmusok feltárása ezért fontos cél a terápiás beavatkozások kifejlesztésében.
Mitokondriális biogenezis: új mitokondriumok képződése
A mitokondriális biogenezis az a folyamat, melynek során a sejtek új mitokondriumokat hoznak létre. Ez elengedhetetlen a sejtek energiaellátásának fenntartásához, különösen azokban a szövetekben, amelyek nagy energiaigénnyel rendelkeznek, mint például az izmok és az agy. A biogenezis nem csupán a mitokondriumok számának növelését jelenti, hanem a meglévő mitokondriumok méretének és funkciójának optimalizálását is.
A folyamat komplex szabályozás alatt áll, és számos tényező befolyásolja, beleértve a táplálkozást, a fizikai aktivitást és a hormonális állapotot. A PGC-1α (peroxiszóma proliferátor-aktivált receptor gamma koaktivátor 1 alfa) kulcsszerepet játszik a biogenezis szabályozásában, aktiválva a mitokondriális gének expresszióját a sejtmagban és a mitokondriumokban egyaránt.
A mitokondriális biogenezis tehát a sejt válasza az energiaigény változásaira, biztosítva a megfelelő ATP-termelést és a sejt túlélését.
A biogenezis zavarai számos betegséghez vezethetnek, beleértve a neurodegeneratív betegségeket, a szív- és érrendszeri problémákat, valamint a metabolikus szindrómát. A mitokondriális biogenezis serkentése ígéretes terápiás célpont lehet ezekben az állapotokban.
A mitokondriumok szerepe a sejthalálban (apoptózis)
A mitokondriumok nem csupán energiatermelő „erőművek”, hanem kulcsszerepet játszanak a sejthalál, azaz az apoptózis szabályozásában is. Bár elsődleges feladatuk az ATP előállítása, a sejthalálban való részvételük egy komplex folyamat eredménye, mely szorosan összefügg a mitokondriális membrán potenciál stabilitásával és a különböző fehérjék felszabadulásával.
A mitokondriális membrán permeabilitásának növekedése (Mitochondrial Outer Membrane Permeabilization – MOMP) az apoptózis kritikus pontja. Ez a folyamat lehetővé teszi a mitokondriumok közötti térből (intermembrán térből) olyan pro-apoptotikus fehérjék kiszabadulását, mint a citokróm c, a Smac/DIABLO, és az AIF (Apoptosis-Inducing Factor). A citokróm c a citoplazmába kerülve aktiválja az apoptoszómát, ami kaszpázokat aktivál, elindítva ezzel a programozott sejthalál végrehajtási fázisát. A Smac/DIABLO az IAP (Inhibitor of Apoptosis Proteins) fehérjéket gátolja, ezzel tovább erősítve az apoptotikus jelet.
A mitokondriumok tehát nem passzív áldozatai a sejthalálnak, hanem aktívan részt vesznek annak végrehajtásában a pro-apoptotikus molekulák felszabadításával, melyek elindítják és felerősítik a kaszpáz kaszkádot.
A mitokondriális membrán potenciál (ΔΨm) csökkenése is fontos jelzés az apoptózis felé. A ΔΨm fenntartása elengedhetetlen az ATP szintézishez, de stabilitásának megbomlása a MOMP-hez és a pro-apoptotikus fehérjék felszabadulásához vezethet. Ezt a folyamatot számos tényező befolyásolhatja, beleértve a reaktív oxigéngyökök (ROS) túlzott termelődését és a Bcl-2 családba tartozó fehérjék egyensúlyát.
A Bcl-2 család tagjai, mint a Bcl-2 és a Bax, szabályozzák a mitokondriális membrán permeabilitását. A pro-apoptotikus Bax fehérjék a mitokondriális membránba épülve pórusokat képeznek, elősegítve a pro-apoptotikus fehérjék kijutását, míg az anti-apoptotikus Bcl-2 fehérjék ezt a folyamatot gátolják. Az ezen fehérjék közötti egyensúly eltolódása a pro-apoptotikus irányba a sejt halálához vezethet.
A mitokondriumok és a kalcium szabályozása
A mitokondriumok kulcsszerepet játszanak a sejtek kalcium-szintjének szabályozásában, ami elengedhetetlen a sejtműködés számos aspektusához. A mitokondriumok képesek kalciumionokat felvenni és leadni, befolyásolva ezzel a citoszol kalcium koncentrációját. Ez a folyamat kritikus a sejtek jelátvitelében és a programozott sejthalál (apoptózis) szabályozásában.
A mitokondriális kalciumfelvételért elsősorban a mitokondriális kalcium uniporter (MCU) felelős, egy csatorna, amely lehetővé teszi a kalcium bejutását a mitokondriális mátrixba. A kalcium leadása pedig különböző mechanizmusokon keresztül történik, beleértve a Na+/Ca2+ antiportert és a H+/Ca2+ antiportert.
A mitokondriális kalciumszabályozás szoros kapcsolatban áll az ATP-termeléssel, mivel a kalcium modulálja bizonyos enzimek aktivitását a citrátkörben, ezáltal befolyásolva az energiatermelést.
A kalcium túlterhelése a mitokondriumokban káros lehet, oxidatív stresszhez és mitokondriális diszfunkcióhoz vezethet, ami hozzájárulhat különböző betegségek kialakulásához, mint például a neurodegeneratív betegségek és a szív- és érrendszeri problémák. Ezért a sejtek finoman szabályozzák a mitokondriális kalcium homeosztázist, hogy biztosítsák a megfelelő energiaellátást és a sejtek egészségét.
Reaktív oxigéngyökök (ROS) termelése és a mitokondriális antioxidáns védelem
A mitokondriumok, az energiatermelés központjai, a reaktív oxigéngyökök (ROS) jelentős forrásai is egyben. Ezek a molekulák az elektron transzportlánc működése során keletkeznek, amikor az oxigén részleges redukciója történik. Bár a ROS-ok kis koncentrációban fontos szerepet töltenek be a sejtek jelátvitelében és a védekező mechanizmusokban, túlzott mennyiségük károsíthatja a mitokondriális DNS-t, a lipideket és a fehérjéket, ami oxidatív stresszhez vezet.
A sejtek rendelkeznek komplex antioxidáns védelmi rendszerekkel a ROS-ok káros hatásainak ellensúlyozására. A mitokondriumokban található antioxidáns enzimek, mint például a szuperoxid-dizmutáz (SOD), a kataláz és a glutation-peroxidáz, kulcsfontosságúak a ROS-ok semlegesítésében. Ezek az enzimek a ROS-okat kevésbé káros anyagokká alakítják, például vízzé és oxigénné.
A mitokondriális antioxidáns védelem hatékonysága döntő fontosságú a mitokondriumok egészségének és működésének fenntartásához, valamint a sejtek oxidatív stresszel szembeni védelméhez.
Az antioxidáns enzimek mellett kis molekulatömegű antioxidánsok is szerepet játszanak a védelemben, mint például a glutation, a C-vitamin és az E-vitamin. Ezek az antioxidánsok közvetlenül reagálnak a ROS-okkal, megakadályozva azok károsító hatásait. A mitokondriális diszfunkció és az oxidatív stressz összefüggésbe hozható számos betegséggel, beleértve az öregedést, a neurodegeneratív betegségeket és a rákot, ezért a mitokondriális antioxidáns védelem megértése és támogatása kritikus fontosságú.
Mitokondriális diszfunkció és betegségek: mitokondriális citopátiák
A mitokondriális diszfunkció, vagyis a mitokondriumok nem megfelelő működése súlyos következményekkel járhat, mivel befolyásolja a sejtek energiaellátását. A mitokondriális citopátiák olyan betegségcsoportot alkotnak, amelyekben a mitokondriumok nem képesek megfelelően ellátni energiatermelő funkciójukat. Ez a diszfunkció genetikai eredetű lehet, mind a mitokondriális DNS (mtDNS), mind a nukleáris DNS mutációi okozhatják.
A mitokondriális citopátiák széles skálán jelentkezhetnek, a tünetek súlyossága és a érintett szervek köre is változatos lehet. Gyakran érintik azokat a szerveket és szöveteket, amelyeknek magas az energiaigényük, mint például az agy, az izmok, a szív és a máj.
A tünetek között előfordulhatnak:
- Izomgyengeség (miopátia)
- Neurológiai problémák (pl. rohamok, ataxia, demencia)
- Szívbetegség (kardiomiopátia)
- Látás- és hallásproblémák
- Emésztési zavarok
- Endokrin rendellenességek (pl. cukorbetegség)
A diagnózis felállítása komplex folyamat, amely magában foglalhatja a klinikai vizsgálatot, a genetikai teszteket (mtDNS és nukleáris DNS analízis), izombiopsziát és egyéb speciális vizsgálatokat.
A mitokondriális citopátiák kezelése jelenleg tüneti, célja a tünetek enyhítése és a beteg életminőségének javítása. Nincs egyetlen gyógymód, amely minden beteg számára alkalmazható lenne.
A kezelési lehetőségek közé tartozhatnak a vitamin- és táplálékkiegészítők (pl. koenzim Q10, L-karnitin), a fizioterápia, a gyógytorna és a speciális diéták. A kutatások folyamatosan zajlanak új terápiás megközelítések kidolgozására, beleértve a génterápiát és a mitokondrium-transzplantációt.
Fontos megjegyezni, hogy a mitokondriális citopátiák ritka betegségek, és a tünetek sok más állapotra is utalhatnak. A pontos diagnózis felállítása szakorvosi feladat.
A mitokondriális diszfunkció szerepe az öregedésben
Az öregedés során a mitokondriumok működése fokozatosan romlik. Ez a mitokondriális diszfunkció kulcsszerepet játszik az öregedési folyamatokban és az életkorral összefüggő betegségek kialakulásában. A mitokondriumok károsodása csökkent energiatermeléshez vezet, ami a sejtek működését negatívan befolyásolja.
Az egyik fő ok a reaktív oxigéngyökök (ROS) fokozott termelése. A sérült mitokondriumok több ROS-t termelnek, ami oxidatív stresszt okoz a sejtekben. Ez a stressz további mitokondriális károsodáshoz vezet, egy ördögi kört létrehozva.
A mitokondriális DNS (mtDNS) különösen érzékeny a károsodásra, mivel nincsenek hisztonok által védve és korlátozottak a javító mechanizmusok. Az mtDNS mutációk felhalmozódása tovább rontja a mitokondriális funkciót.
A mitokondriális diszfunkció az öregedés során nem csupán az energiatermelés csökkenéséhez vezet, hanem a sejtek közötti kommunikáció zavaraihoz, a gyulladás fokozódásához és az apoptózis (programozott sejthalál) szabályozásának felborulásához is.
Ezek a folyamatok hozzájárulnak az olyan betegségek kialakulásához, mint az Alzheimer-kór, a Parkinson-kór, a cukorbetegség és a szív- és érrendszeri betegségek. A mitokondriális diszfunkció elleni stratégiák, például az antioxidánsok alkalmazása és a kalória-restrikció, ígéretes lehetőségeket kínálnak az egészséges öregedés elősegítésére.
Mitokondriális diszfunkció és neurodegeneratív betegségek (Alzheimer, Parkinson)
A mitokondriális diszfunkció központi szerepet játszik számos neurodegeneratív betegség, köztük az Alzheimer-kór (AD) és a Parkinson-kór (PD) patogenezisében. Mivel az idegsejtek rendkívül energiaigényesek, és nagymértékben támaszkodnak a mitokondriumok által termelt ATP-re, a mitokondriális működés zavarai különösen károsak rájuk.
Alzheimer-kór esetén a béta-amiloid plakkok és a tau fehérje hiperfoszforilációja mellett a mitokondriális funkciók is jelentősen károsodnak. Ez a károsodás magában foglalja a csökkent ATP-termelést, a megnövekedett reaktív oxigéngyökök (ROS) termelését, és a kalcium homeosztázis zavarait. A ROS túlzott termelése oxidatív stresszt okoz, ami tovább károsítja a mitokondriumokat és a sejteket.
Parkinson-kórban a substantia nigra dopaminerg neuronjai különösen érzékenyek a mitokondriális diszfunkcióra. Számos genetikai mutáció, például a PARK2, PINK1 és LRRK2 génekben, amelyek a mitokondriális minőségellenőrzésben (mitofágia) és a mitokondriális dinamikában vesznek részt, összefüggésbe hozhatók a PD kialakulásával. Ezek a mutációk a mitokondriumok károsodásához, a sejtek energiaellátásának csökkenéséhez és a dopaminerg neuronok pusztulásához vezetnek.
A mitokondriális diszfunkció mind az Alzheimer-kór, mind a Parkinson-kór esetén egy közös patológiai mechanizmus, amely hozzájárul a neuronális károsodáshoz és a betegségek progressziójához.
A mitokondriális diszfunkció következményei közé tartozik továbbá a neuroinflammáció fokozódása is. A sérült mitokondriumok gyulladásos válaszokat válthatnak ki, amelyek tovább súlyosbítják a neuronális károsodást. A mitokondriumok és a neuroinflammáció közötti kölcsönhatás egy komplex folyamat, amely jelentős szerepet játszik a neurodegeneratív betegségek patogenezisében.
Mitokondriális diszfunkció és a szív- és érrendszeri betegségek
A mitokondriális diszfunkció kulcsszerepet játszik számos szív- és érrendszeri betegség kialakulásában. A szívizomsejtek rendkívül energiaigényesek, működésük szinte teljes mértékben a mitokondriumok által termelt ATP-től függ. Ha a mitokondriumok nem képesek elegendő energiát előállítani, a szívizomzat működése károsodik.
A mitokondriális diszfunkció számos módon járul hozzá a szívbetegségekhez. Például, a csökkent ATP-termelés szívritmuszavarokhoz vezethet. Emellett a diszfunkcionális mitokondriumok túlzott mennyiségű reaktív oxigéngyököt (ROS) termelnek, amelyek oxidatív stresszt okoznak. Ez a stressz károsítja a sejtszervecskéket, a DNS-t és a fehérjéket, ami gyulladáshoz és szövetkárosodáshoz vezet a szívben és az erekben.
A mitokondriális diszfunkció direkt módon hozzájárulhat a szívelégtelenség, a koszorúér-betegség, a magas vérnyomás és a cardiomyopathia kialakulásához.
A mitokondriális diszfunkció emellett befolyásolja a kalcium-homeosztázist a szívizomsejtekben, ami a szívizomzat összehúzódásának és elernyedésének zavaraihoz vezethet. A genetikai mutációk is okozhatnak mitokondriális diszfunkciót, növelve a szívbetegségek kockázatát. A kutatások szerint a mitokondriális funkció javítása lehetőséget kínálhat a szív- és érrendszeri betegségek megelőzésére és kezelésére.
Mitokondriális diszfunkció és a rák
A mitokondriális diszfunkció szorosan összefügg a rák kialakulásával és progressziójával. Míg a normál sejtek a mitokondriális oxidatív foszforiláció (OXPHOS) révén termelik az energiát, a rákos sejtek gyakran a glikolízist részesítik előnyben, még oxigéndús környezetben is (Warburg-effektus). Ez a váltás energia-termelési módban összefügghet a mitokondriális működés zavaraival.
A mitokondriális diszfunkció a rákos sejtekben többféleképpen is megnyilvánulhat. Például, a mitokondriális DNS (mtDNS) mutációi, a légzési lánc komplexek hibái, és a mitokondriális membránpotenciál csökkenése mind hozzájárulhatnak a csökkent energia-termeléshez és a reaktív oxigéngyökök (ROS) fokozott termeléséhez. A ROS károsíthatja a DNS-t, a fehérjéket és a lipideket, elősegítve ezzel a genetikai instabilitást és a sejtek mutációját.
A mitokondriális diszfunkció nem csak a rákos sejtek energia-termelését befolyásolja, hanem a sejtek programozott halálát (apoptózis) is. A hibás mitokondriumok kevésbé képesek az apoptózis útvonalának aktiválására, lehetővé téve a rákos sejtek számára, hogy elkerüljék a pusztulást és tovább szaporodjanak.
Emellett a mitokondriális diszfunkció befolyásolhatja a tumor mikrokörnyezetét is. A mitokondriumok szerepet játszanak a kalcium-szabályozásban és a jelátviteli útvonalakban, amelyek befolyásolják az immunválaszt és az angiogenezist (érképzés). A mitokondriális működés zavarai elősegíthetik a tumor növekedését és áttétképzését.
A mitokondriumok szerepe a cukorbetegségben
A mitokondriumok kulcsszerepet játszanak a cukorbetegség kialakulásában és progressziójában. Mivel ők felelősek a sejtek energiaellátásáért, a működésük zavara közvetlenül befolyásolja a glükóz metabolizmusát és az inzulinrezisztenciát.
A mitokondriális diszfunkció, ami a cukorbetegek szöveteiben gyakran megfigyelhető, csökkenti az ATP termelést és növeli a reaktív oxigéngyökök (ROS) képződését. Ez az oxidatív stressz tovább rontja a mitokondriumok működését, egy ördögi kört generálva.
Az inzulinrezisztencia, a 2-es típusú cukorbetegség egyik fő jellemzője, szoros kapcsolatban áll a vázizomzat mitokondriális funkciójával. A csökkent mitokondriális oxidációs kapacitás azt eredményezi, hogy a glükóz és a zsírsavak nem oxidálódnak megfelelően, hanem felhalmozódnak a sejtekben, ami tovább rontja az inzulinérzékenységet.
A mitokondriális diszfunkció nem csupán következménye, hanem okozója is lehet a cukorbetegségnek, mivel a károsodott energiaellátás és a megnövekedett oxidatív stressz hozzájárul a béta-sejtek pusztulásához a hasnyálmirigyben, ami inzulinhiányhoz vezet.
Kutatások kimutatták, hogy a mitokondriális funkció javítása, például testmozgással vagy bizonyos gyógyszerekkel, javíthatja a glükóz kontrollt és csökkentheti a cukorbetegség szövődményeinek kockázatát.
Mitokondrium-célzott terápiás megközelítések
A mitokondriumok kulcsszerepet játszanak számos betegségben, így a mitokondrium-célzott terápiás megközelítések egyre nagyobb figyelmet kapnak. Ezek a terápiák célja a mitokondriális diszfunkció okozta problémák kezelése.
Számos stratégia létezik, beleértve a mitokondriális antioxidánsokat, amelyek a szabadgyökök okozta károkat csökkentik. Ilyen például a MitoQ, mely célzottan a mitokondriumokban fejti ki hatását. További megközelítés a mitokondriális biogenezis serkentése, ami új mitokondriumok képződését ösztönzi. Ezt gyógyszerekkel és életmódbeli változtatásokkal, például testmozgással lehet elérni.
A mitokondriális DNS (mtDNS) javítása is egy ígéretes terület. Bár az mtDNS mutációk kezelése bonyolult, a génterápia és a CRISPR-technológia új lehetőségeket kínál. Emellett a metabolikus terápiák, melyek a sejt energiaellátását befolyásolják, szintén fontos szerepet játszanak. Ilyen például a ketogén diéta, mely a glükóz helyett zsírokat használ energiaforrásként.
A mitokondrium-célzott terápiák célja nem csupán a tünetek enyhítése, hanem a betegségek kiváltó okának, a mitokondriális diszfunkciónak a kezelése.
Azonban fontos megjegyezni, hogy ezen terápiák többsége még kísérleti fázisban van, és további kutatások szükségesek a hatékonyságuk és biztonságosságuk igazolásához. A klinikai vizsgálatok kulcsfontosságúak a mitokondrium-célzott terápiák jövőbeli alkalmazásában.
A mitokondriális funkció mérésének módszerei
A mitokondriális funkció mérésére számos módszer áll rendelkezésünkre, melyek különböző aspektusait vizsgálják az energiatermelő folyamatoknak. Ezek a módszerek elengedhetetlenek a mitokondriális diszfunkcióval összefüggő betegségek kutatásában és diagnosztizálásában.
Az egyik leggyakoribb módszer az oxigénfogyasztás mérése, melyet általában oxigén elektródával végeznek. Ez az eljárás lehetővé teszi a légzési lánc aktivitásának, és ezáltal az ATP-termelés sebességének meghatározását. Emellett a membránpotenciál mérése fluoreszcens festékekkel vagy elektródákkal fontos információt szolgáltat a mitokondriumok egészségi állapotáról.
A mitokondriális enzimek aktivitásának mérésére spektrofotometriás módszereket használnak, melyekkel a légzési lánc egyes komponenseinek (pl. komplex I, II, IV) működését lehet vizsgálni. A mitokondriális DNS (mtDNS) mennyiségének és minőségének vizsgálata is fontos, hiszen a mtDNS károsodása jelentős mértékben befolyásolhatja a mitokondriális funkciót.
A mitokondriális funkció átfogó megítéléséhez gyakran kombinálják a különböző mérési módszereket, így nyerve teljesebb képet a sejt energiaellátásának állapotáról.
Végül, de nem utolsósorban, a mitokondriális morfológia vizsgálata elektronmikroszkóppal vagy fluoreszcens mikroszkóppal szintén értékes információt nyújt a mitokondriumok szerkezetéről és eloszlásáról a sejten belül. A fragmentált vagy duzzadt mitokondriumok gyakran diszfunkcióra utalnak.
Életmódbeli tényezők hatása a mitokondriális működésre (táplálkozás, mozgás)
Életmódunk jelentősen befolyásolja mitokondriumaink hatékonyságát. A helyes táplálkozás kulcsfontosságú a megfelelő üzemanyag biztosításához. A feldolgozott élelmiszerek, a magas cukortartalmú diéták és a telített zsírok károsíthatják a mitokondriális membránokat, rontva az energiatermelést. Ezzel szemben az antioxidánsokban gazdag étrend, amely bogyós gyümölcsöket, zöld leveles zöldségeket és omega-3 zsírsavakat tartalmaz, védi a mitokondriumokat a károsodástól.
A rendszeres testmozgás az egyik leghatékonyabb módja a mitokondriális funkció javításának. A mozgás serkenti a mitokondriumok szaporodását (mitogenezis), ezáltal növelve a sejtek energiatermelő képességét. Különösen hatékony a HIIT (High-Intensity Interval Training), mivel rövid, intenzív szakaszok váltakoznak pihenőidővel, ami fokozza a mitokondriális biogenezist.
A rendszeres testmozgás és a tudatos táplálkozás kombinációja a legerősebb eszköz a mitokondriális egészség megőrzéséhez és az optimális energiatermelés biztosításához.
Fontos megjegyezni, hogy a krónikus stressz negatívan befolyásolhatja a mitokondriumok működését. A stresszkezelési technikák, mint például a meditáció és a jóga, segíthetnek csökkenteni a stressz hatásait és megőrizni a mitokondriális egészséget. A megfelelő alvás szintén elengedhetetlen a mitokondriumok regenerálódásához és hatékony működéséhez.
A mitokondriumok és a környezeti toxinok
A mitokondriumok, sejtjeink energiaközpontjai, különösen érzékenyek a környezeti toxinok hatásaira. Ezek a toxinok, mint például a nehézfémek (ólom, higany), a peszticidek, és bizonyos ipari vegyületek, közvetlenül károsíthatják a mitokondriális membránokat és enzimeket.
A toxinok gátolhatják az elektrontranszportláncot, ami az ATP (adenozin-trifoszfát), a sejt fő energiaforrásának termeléséhez szükséges. Ez energiahiányhoz vezethet, ami számos betegség kialakulásához hozzájárulhat.
A mitokondriumok károsodása fokozott oxidatív stresszt is eredményezhet. A toxinok által kiváltott oxidatív stressz tovább roncsolja a mitokondriális DNS-t és fehérjéket, ami egy ördögi körhöz vezet.
A környezeti toxinoknak való kitettség tehát jelentősen befolyásolhatja a mitokondriális működést, és ezáltal a sejtek energiaellátását, ami hosszú távon komoly egészségügyi problémákhoz vezethet.
Fontos megjegyezni, hogy a mitokondriumok bizonyos mértékig képesek regenerálódni és alkalmazkodni a környezeti hatásokhoz. A megfelelő táplálkozás, a rendszeres testmozgás, és a toxinok elkerülése mind segíthetnek megőrizni a mitokondriumok egészségét és optimális működését.
Mitokondriális donor terápia (háromszülős eljárás)
A mitokondriális donor terápia, más néven háromszülős eljárás, egy forradalmi technika, melynek célja a mitokondriális betegségek átörökítésének megakadályozása. Ezek a betegségek a mitokondriumok hibás működéséből adódnak, ami súlyos energiahiányhoz vezet a sejtekben.
A terápia lényege, hogy a leendő gyermek mitokondriumait egy harmadik, egészséges donortól kapja, miközben a nukleáris DNS-e a szülőktől származik.
Két fő eljárás létezik: a pronukleáris transzfer és a petesejtmag transzfer. Mindkettő célja, hogy az anya petesejtjének magját (mely a genetikai információt hordozza) átültessék egy donor petesejtbe, melynek saját magját eltávolították. Ez biztosítja, hogy a gyermek a szülők genetikai anyagát örökli, de egészséges mitokondriumokkal rendelkezzen, amelyek képesek a megfelelő energiaellátásra.
Bár a technika ígéretes, etikai kérdéseket is felvet, és szigorú szabályozás alá esik. Fontos megjegyezni, hogy a gyermek a donor mitokondriális DNS-ének egy kis mennyiségét hordozza, ami elenyésző a szülők nukleáris DNS-éhez képest, de mégis befolyásolhatja a sejtjeinek energia-termelő képességét.
A mitokondriumok szerepe a sejt jelátvitelben
A mitokondriumok nem csupán az energiatermelés központjai; kulcsfontosságú szerepet játszanak a sejt jelátviteli folyamataiban is. A kalcium-ionok koncentrációjának szabályozásában vesznek részt, ami elengedhetetlen számos sejtfolyamathoz, mint például az izomösszehúzódáshoz és a neurotranszmitterek felszabadulásához.
A mitokondriális membránpotenciál (ΔΨm) változásai jelzőmolekulaként funkcionálhatnak, jelezve a sejt stresszállapotát. Például a reaktív oxigéngyökök (ROS) termelése, ami a mitokondriális működés mellékterméke, fontos szerepet játszik a sejt jelzésében, és befolyásolhatja a sejt sorsát, beleértve az apoptózist (programozott sejthalált) is.
A mitokondriumok az apoptózisban is aktívan részt vesznek, mivel a mitokondriális membrán permeabilitásának növekedése (MMP) citokróm c felszabadulásához vezet, ami az apoptotikus kaszkád egyik elindítója.
Továbbá, a mitokondriumok közvetlenül kommunikálhatnak a sejtmaggal, befolyásolva a génexpressziót. Ez a kommunikáció lehetővé teszi a sejt számára, hogy adaptálódjon a változó energiaigényekhez és a stresszhatásokhoz.